Indice
Trietilalluminio
| Trietilalluminio | |
|---|---|
 | |
| Nome IUPAC | |
| Trieltilalluminio | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C12H30Al2 |
| Massa molecolare (u) | 228,33 |
| Aspetto | liquido incolore |
| Numero CAS | |
| Numero EINECS | 202-619-3 |
| PubChem | 16682930 |
| SMILES | CC[Al](CC)CC |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 0,835 |
| Solubilità in acqua | reazione violenta |
| Temperatura di fusione | –50 °C (223 K) |
| Temperatura di ebollizione | 128–130 °C (401–403 K) a 50 mmHg |
| Indicazioni di sicurezza | |
| Punto di fiamma | −18 °C (255 K) |
| Simboli di rischio chimico | |
 
| |
| pericolo | |
| Frasi H | 250 - 260 - 314 |
| Consigli P | 210 - 222 - 223 - 231+232 - 260 - 264 - 280 - 301+330+331 - 302+334 - 303+361+353 - 304+340 - 305+351+338 - 310 - 321 |
Il trietilalluminio è un composto organometallico dell'alluminio, normalmente abbreviato come TEA. In condizioni normali si presenta come un liquido incolore; è piroforico (si infiamma immediatamente a contatto con l'aria) e reagisce violentemente con l'acqua, liberando gas infiammabili. Viene conservato in recipienti di acciaio inossidabile o come liquido puro, o in soluzione di solventi idrocarburici come esano, eptano o toluene. Il TEA è usato in molti processi industriali, soprattutto per la produzione di polietilene e di alcoli a catena lineare. Se ne consumano centinaia di migliaia di tonnellate all'anno.[1]
Struttura
[modifica | modifica wikitesto]
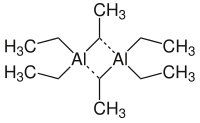
In soluzione e allo stato solido il composto ha una struttura dimera con formula Al2Et6, dove Et è l'abbreviazione del gruppo etile, –CH2CH3. Due gruppi etile fungono da leganti a ponte e quattro sono terminali. I due atomi di carbonio che legano a ponte sono pentacoordinati. Il tipo di legame ricorda quello del diborano, e coinvolge legami a tre centri e due elettroni. Al pari del trimetilalluminio, anche il TEA è una molecola flussionale, con un rapido interscambio tra i gruppi etile terminali e a ponte. A temperatura più elevata in fase gassosa sono presenti unità monomere AlEt3.[2]
Sintesi
[modifica | modifica wikitesto]Il TEA può essere preparato con vari processi. La scoperta di una sintesi efficiente è stata importante per le applicazioni industriali che utilizzano il TEA. Il processo più usato richiede più stadi e si può riassumere con la reazione:[1]
- 2Al + 3H2 + 6C2H4 → Al2Et6
Dato che questa sintesi è molto efficiente, il TEA è uno dei composti organometallici dell'alluminio più facilmente disponibili.
Il TEA si può ottenere anche dal tricloruro di trietilalluminio, Al2Cl3Et3, che si ottiene trattando la polvere di alluminio con cloroetano, C2H5Cl. Per riduzione del tricloruro di trietilalluminio con un metallo alcalino come il sodio si ottiene il TEA:[1]
- 3Al2Cl3Et3 + 9Na → 2Al2Et6 + 2Al + 9NaCl
Reattività
[modifica | modifica wikitesto]Il legame Al–C è polarizzato e quindi il TEA reagisce rapidamente e violentemente con sostanze protiche come acidi minerali, acqua, ammoniaca, mercaptani, fenoli. La reazione porta a liberare etano:[3]
- Al2Et6 + 6HX → 2Al2X6 + 6EtH
Per questa reazione bastano anche acidi deboli come acetileni monosostituiti e alcoli.[1]
Con l'ossigeno atmosferico il TEA si infiamma spontaneamente perché la reazione è radicalica e molto esotermica. Se condotta in modo controllato la reazione porta agli alcossidi:[1]
- Al2Et6 + 3O2 → 2Al(OEt)3
Nel TEA la connessione tra i due centri di alluminio è relativamente debole, e può essere rotta da basi (L) per formare addotti di formula LAlEt3; in questi composti il centro di alluminio è coordinato con geometria tetraedrica.[4]
- Al2Et6 + 2L → 2LAlEt3
Applicazioni
[modifica | modifica wikitesto]L'applicazione economicamente più importante del TEA è l'utilizzo come co-catalizzatore nei catalizzatori di Ziegler-Natta per la produzione di poliolefine, in particolare polietilene e polipropilene. Il TEA ha la funzione di ridurre un complesso metallico, di solito a base di titanio, formando la specie cataliticamente attiva; di conseguenza questa applicazione consuma una parte relativamente piccola della produzione mondiale di TEA.[1]
La maggior parte del TEA è consumato in processi di tipo non catalitico, in primo luogo per ottenere alcoli primari lineari. Inizialmente il TEA serve per oligomerizzare l'etilene e ottenere una miscela di composti di "trialchilalluminio", qui semplificati con il gruppo ottile:
- Al2(C2H5)6 + 18C2H4 → Al2(C8H17)6
In seguito, i composti trilachilici sono ossidati ad alcossidi con ossigeno, e quindi idrolizzati:
- Al2(C8H17)6 + 3/2O2 → Al2(OC8H17)6
- Al2(OC8H17)6 + 3/2H2O → 6C8H17OH + 2"Al(OH)3"
Gli alcoli lineari ottenuti sono poi utilizzati nella produzione di copolimeri, detergenti e lubrificanti.[1]
Come agente piroforico
[modifica | modifica wikitesto]Il TEA si infiamma a contatto con l'aria e si decompone infiammandosi con l'acqua e altri ossidanti.[5] È una delle poche sostanze abbastanza piroforiche da accendersi a contatto con l'ossigeno liquido. Queste proprietà piroforiche lo rendono interessante per l'accensione di motori a razzo. Si potrebbe utilizzare anche come propellente liquido, ma non è stato usato in nessun mezzo arrivato alla produzione.[6] Il lanciatore Falcon 9 prodotto dalla SpaceX usa una miscela TEA-trietilborano per l'accensione del primo stadio.[7]
Il TEA mescolato all'addensante poliisobutilene è stato inoltre usato come arma incendiaria, alternativamente al napalm, nei lanciagranate M202.[8]
Sicurezza
[modifica | modifica wikitesto]Il TEA è un composto pericoloso, da trattare con molta attenzione. Deve essere conservato e utilizzato in atmosfera inerte, dato che si infiamma spontaneamente all'aria. Reagisce violentemente con l'acqua, liberando etano (infiammabile). In caso di contatto provoca gravi ustioni a pelle e mucose e gravi lesioni oculari. Non ci sono dati che indichino proprietà cancerogene. Viene considerato poco pericoloso per l'ambiente.[5]
Note
[modifica | modifica wikitesto]- ^ a b c d e f g Krause et al. 2002
- ^ Vass et al. 2002
- ^ Elschenbroich 2006
- ^ Housecroft e Sharpe 2008
- ^ a b Alfa Aesar, Scheda di dati di sicurezza del trietilalluminio (PDF) [collegamento interrotto], su alfa.com. URL consultato il 17 ottobre 2011.
- ^ Clark 1972
- ^ Spaceflight Now, Mission Status Center, June 2, 2010, 1905 GMT, su spaceflightnow.com. URL consultato il 17 ottobre 2011.
- ^ M202A1 Flame Assault Shoulder Weapon, su inetres.com. URL consultato il 17 ottobre 2011.
Bibliografia
[modifica | modifica wikitesto]- (EN) J. D. Clark, Ignition! An Informal History of Liquid Rocket Propellants, New Brunswick, NJ, Rutgers University Press, 1972.
- (EN) Christoph Elschenbroich, Organometallics, Weinheim, Wiley-VCH, 2006, ISBN 978-3-527-29390-2.
- (EN) C. E. Housecroft, A. G. Sharpe, Inorganic chemistry, 3ª ed., Harlow (England), Pearson Education Limited, 2008, ISBN 978-0-13-175553-6.
- (EN) M. J. Krause, F. Orlandi, A. T. Saurage, J. R. Zietz Jr., Aluminum Compounds, Organic, in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 2002, DOI:10.1002/14356007.a01_543.
- (EN) G. Vass, G. Tarczay, G. Magyarfalvi, A. Bödi, L. Szepes, HeI Photoelectron Spectroscopy of Trialkylaluminum and Dialkylaluminum Hydride Compounds and Their Oligomers, in Organometallics, vol. 21, n. 13, 2002, pp. 2751–2757, DOI:10.1021/om010994h.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Trietilalluminio
Wikimedia Commons contiene immagini o altri file su Trietilalluminio
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) triethylaluminum, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.









