Splicing

In biologia molecolare e in genetica, splicing (dall'inglese: montaggio) è una modifica del nascente pre-mRNA che avviene insieme o dopo la trascrizione, nella quale gli introni sono rimossi e gli esoni vengono uniti. Ciò è necessario per il tipico RNA messaggero prima che possa essere usato per produrre una corretta proteina tramite la traduzione o sintesi proteica.
La maggior parte dei geni eucariotici sono costituiti da regioni codificanti (esoni) alternate a regioni non codificanti (introni). Queste ultime devono necessariamente essere rimosse dal trascritto primario per consentire la corretta traduzione e sintetizzare la proteina corrispondente. Alcuni introni sono presenti anche nei geni degli Archea, mentre sono assenti in quelli dei Bacteria. Dopo la trascrizione da parte della RNA polimerasi il trascritto primario va incontro a numerose modificazioni.
I tratti da eliminare si chiamano introni (fino a 2000 basi); i tratti che codificano si chiamano esoni.
Il macchinario dello splicing: lo spliceosoma
[modifica | modifica wikitesto]Chimicamente lo splicing avviene per due successive reazioni di transesterificazione, grazie alle quali legami fosfodiesterici sul pre-mRNA vengono rotti e altri nuovi formati. Queste reazioni sono mediate da un meccanismo molecolare che coinvolge più componenti, chiamato spliceosoma. Le sue dimensioni sono simili a quelle di un ribosoma ed è composto da circa 150 proteine e 5 RNA. Sono proprio questi ultimi a riconoscere le sequenze ai confini introne-esone ed almeno uno a partecipare alla catalisi della reazione, comportandosi come da ribozima. Per le sue reazioni lo spliceosoma idrolizza diverse molecole di ATP. I cinque RNA (U1, U2, U4, U5 e U6) sono chiamati piccoli RNA nucleari (snRNA, small nuclear RNA). Ognuno di questi si complessa con diverse proteine del macchinario, formando complessi, chiamati ribonucleoproteine nucleari (snRNP, small nuclear ribonuclear protein). La composizione dello spliceosoma varia a seconda dei passaggi della reazione: snRNP diverse entrano ed escono dalla reazione in momenti diversi, ed ognuna ha una sua funzione particolare. Le snRNP rivestono tre ruoli nello splicing: riconoscono il sito di splicing 5' e il punto di ramificazione; portano questi siti vicini quando occorre e catalizzano il taglio e la giunzione dell'RNA. Per tali funzioni sono essenziali le interazioni RNA-RNA, proteina-RNA e proteina-proteina.
La prima interazione avviene tramite l'accoppiamento di basi complementari, tra l'snRNA U1 e il sito di splicing 5' del pre-mRNA. Nel corso della reazione, questo sito di splicing viene riconosciuto dall'snRNA U6. Un altro esempio di appaiamento tra le basi è il riconoscimento del punto di ramificazione da parte dell'snRNA U2, oppure l'interazione tra gli snRNA U2 e U6. Questa interazione avvicina il sito di splicing 5' e il punto di ramificazione. Sono proprio queste interazioni e i successivi riarrangiamenti che ne conseguono che guidano la reazione di splicing e contribuiscono alla sua precisione. Anche alcune proteine non complessate con l'RNA sono coinvolte nello splicing: il fattore ausiliario U2 (U2AF) riconosce il segmento polipirimidinico e il sito di splicing 3', così che, nella fase iniziale della reazione di splicing, aiuta il legame di un'altra proteina (BBP, branch-point binding protein) al punto di ramificazione. La BBP sarà poi spiazzata dalla snRNP U2. Le altre proteine facilitano il legame tra RNA e snRNP.
Le fasi dello splicing
[modifica | modifica wikitesto]Inizialmente, il sito di splicing 5' viene riconosciuto dalla snRNP U1. Una delle subunità di U2AF si lega al segmento polipirimidinico, mentre l'altra si lega al sito di splicing 3'.
La prima subunità interagisce con BBP e aiuta questa proteina a legarsi al punto di ramificazione. Questo arrangiamento di proteine e RNA è chiamato complesso precoce E.
A questo punto, la snRNP U2 si lega al punto di ramificazione, con l'aiuto di U2AF, e spiazza BBP. Questo arrangiamento è chiamato complesso A. L'appaiamento di basi tra l'snRNA U2 e il punto di ramificazione è tale che il residuo A del punto di ramificazione venga spinto fuori dal segmento risultante a doppia elica di RNA e formi una protuberanza a singolo nucleotide. Questa A diventa così non accoppiata e disponibile per la reazione con il sito di splicing 5'.
La fase successiva è il riarrangiamento del complesso A per l'avvicinamento di tutti e tre i siti di splicing. Questo avviene in una serie di fasi: le snRNP U4 e U6, assieme alla snRNP U5, si uniscono al complesso. Queste tre snRNP assieme sono dette tripla snRNP U4\U6*U5, in cui le snRNP U4 e U6 sono tenute assieme dall'accoppiamento complementare delle basi dei loro corrispettivi snRNA, mentre la snRNP U5 è legata in maniera più lassa attraverso interazioni proteina-proteina. Con l'ingresso della tripla snRNP U4\U6*U5 il complesso A diventa complesso B.
Nel passaggio successivo, U1 lascia il complesso e U6 lo rimpiazza al sito di splicing 5'. Questo richiede che l'appaiamento tra l'snRNP U1 e il pre-mRNA venga rotto per permettere all'RNA U6 di riappaiarsi nella stessa regione. Questi passaggi completano l'assemblaggio.
Il riarrangiamento successivo innesca la catalisi ed avviene nel modo che segue: U4 viene rilasciato dal complesso permettendo ad U6 di interagire con U2. Questo arrangiamento, chiamato complesso C, produce il sito attivo. Cioè il riarrangiamento avvicina all'interno dello spliceosoma quei componenti che assieme formano il sito attivo. Questo stesso riarrangiamento assicura che l'RNA substrato sia posizionato correttamente. Il fatto che la formazione del sito attivo sia successiva al completamento dell'assemblaggio dello spliceosoma rende il sito attivo disponibile solo nei siti di splicing corretto.
La formazione del sito attivo mette in prossimità il sito di splicing 5' del pre-mRNA e il punto di ramificazione, facilitando la prima reazione di transesterificazione.
La seconda reazione, tra i siti di splicing 5' e 3', è supportata dalla snRNP U5, che aiuta ad avvicinare i due esoni. Il passaggio finale implica il rilascio dell'mRNA e delle snRNP. Queste sono prima legate al cappio formatosi, ma vengono rilasciate in seguito alla rapida degradazione di questo frammento di RNA.
Sequenze dell'mRNA che determinano lo splicing
[modifica | modifica wikitesto]Il confine tra esone e introne, o più specificatamente il limite all'estremità 5' dell'introne, è detto sito di splicing al 5'. Il confine introne-esone all'estremità 3' è detto sito di splicing al 3'. Questi ultimi vengono chiamati rispettivamente sito donatore e sito accettore. Per il meccanismo di splicing è necessaria un'altra sequenza che è chiamata punto di ramificazione (branch point site); quest'ultima si trova all'interno dell'introne,di solito vicino alla sua estremità 3' ed è seguita da un segmento di polipirimidine (Py tract). Le sequenze più conservate sono GU al sito di splicing 5' e AG al sito di splicing 3'; infine vi è la A, che rappresenta il punto di ramificazione. Queste sequenze conservate si trovano tutte all'interno degli introni; ciò è abbastanza normale dato che le sequenze della maggior parte degli esoni, al contrario di quelle introniche, rispondono alla necessità di codificare per gli aminoacidi specifici per i loro prodotti proteici.
Esistono ulteriori sequenze di splicing non canoniche sostituibili a GU/AG, quali AU/AC, riconosciute di RNA U differenti.[1]
Autosplicing
[modifica | modifica wikitesto]Alcuni rari introni sono capaci di "autocatalisi", ovvero la parte intronica dell'RNA trascritto è un ribozima che catalizza la propria escissione, con meccanismo diverso a seconda che l'introne sia di I o di II gruppo:
Lo splicing degli introni del gruppo I necessita di un nucleoside guaninico, usato come nucleofilo: il suo –OH in 3' si lega all'estremità 5' dell'introne con un legame fosfodiesterico 3'-5' al primo nucleoside dell'introne. L'ossidrile in 3' dell'esone precedente agisce da nucleofilo completando la reazione e congiungendo i due esoni.
Per gli introni del gruppo II, la reazione è simile, ma il primo nucleofilo ad agire non è un nucleoside esterno, bensì un –OH in 2' di un residuo adenilato all'interno dell'introne.
Questo meccanismo, definito "autocatalitico" perché può avvenire anche in completa assenza di proteine, riguarda rari introni di alcuni geni degli organelli degli eucarioti (gruppo II), dei geni nucleari codificanti l'rRNA di qualche eucariote (gruppo I) e di qualche gene procariotico (entrambi i gruppi).
Splicing catalizzato
[modifica | modifica wikitesto]Il terzo gruppo di introni, che è quello più comune e che riguarda la maggior parte degli introni dei geni nucleari degli eucarioti, mostra lo stesso meccanismo di formazione del cappio utilizzando una "A" interna all'introne, di solito prossima al 3', tuttavia necessita di complessi di RNA e proteine chiamati Piccole Ribonucleoproteine Nucleari (small nuclear ribonucleoproteins o snRNP) contenenti sequenze di 100-200 nucleotidi chiamati snRNA o RNA U. Quando il complesso si lega al trascritto primario si forma lo spliceosoma. Nonostante, anche in questo caso, la catalisi sia portata avanti proprio da questi piccoli RNA, che agiscono quindi come ribozimi, il meccanismo è chiaramente assistito e quindi non autocatalitico.
Una quarta classe di introni, esemplificati da alcuni piccoli introni ritrovati nei geni che codificano tRNA in eucarioti inferiori, mostrano meccanismo molto diverso, che prevede un taglio dell'introne da parte di un enzima specifico endonucleasi, seguita da ricongiungimento degli esoni da parte di una RNA Ligasi ATP-dipendente ATP.
Esiste un ulteriore tipo catalizzato, chiamato trans-splicing che salda due esoni di trascritti primari differenti.
Queste ultime classi sono riscontrabili solo negli eucarioti.
Riconoscimento dell'introne
[modifica | modifica wikitesto]Nel caso degli introni del terzo gruppo, nella stragrande maggioranza dei casi gli introni iniziano con la sequenza GU e terminano con la sequenza AG; queste sequenze sono riconosciute dalle macchine molecolari che devono catalizzare la giuntatura, ovvero le snRNP. Tuttavia si è riscontrato che all'interno della sequenza intronica queste coppie possono ripetersi: quindi si è ipotizzato che gli spliceosomi riconoscano altre sequenze contigue. A questo riconoscimento partecipano numerose altre proteine accessorie che vanno sotto il nome generale di "RNA-binding proteins". Un numero molto piccolo di introni della terza classe presenta, invece, sequenze alternative AT-AC. In questo caso, esistono varianti speciali delle snRNP, in grado di riconoscere i confini di questi introni.
Splicing alternativo
[modifica | modifica wikitesto]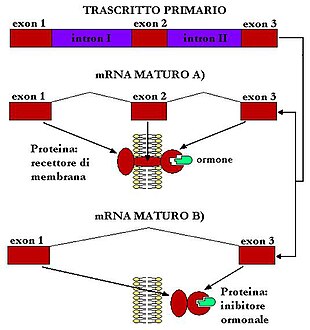
Questa ricorrenza (non straordinaria) di coppie GU e AG, segnala un'altra possibilità. Gli introni possono essere escissi in maniere diverse, è il caso dello splicing alternativo - cioè il processo attraverso il quale, mediante un diverso arrangiamento degli esoni (regioni di RNA codificanti), da uno stesso gene possono derivare diverse proteine, dette isoforme.
Recenti stime basate su dati di RNA-Seq affermano che il 90%, 60% e il 25% dei geni di Homo sapiens, Drosophila melanogaster e Caenorhabditis elegans subiscono splicing alternativo[2].
Sull'mRNA è possibile individuare dei siti di splicing "forti" e altri siti "deboli"; questi ultimi sono dei siti criptici ossia siti che normalmente non sono riconosciuti come siti di splicing e che invece, vengono identificati come tali, in particolari condizioni: il riconoscimento di tali siti permette la produzione di proteine differenti a partire dallo stesso mRNA.
Da cosa dipende il riconoscimento di questi siti di splicing? Una regione molto importante è quella che è situata tra il sito di ramificazione e il 3' dell'introne ad una distanza di 20-50 bp dall'estremità 3'. Questa regione è ricca in pirimidine ; il riconoscimento del sito di splicing al 3' dipende proprio dalla vicinanza di quest'ultimo al sito di pirimidine.
Per fare un esempio, ammettiamo di avere tre esoni (e1, e2, e3) intercalati da due introni (iI, iII), la cellula può decidere di eliminare iI e iII dando così vita al mRNA e1-e2-e3, oppure può eliminare iI e iII assieme all'esone centrale e2, formando così l'mRNA e1-e3. Ciò porterà alla traduzione di due proteine diverse. Ad esempio: se l'mRNA e1-e2-e3 codifica un recettore di membrana, dove e2 codifica la parte idrofobica del polipeptide transmembrana, l'mRNA e1-e3 codificherà una proteina simile alla prima ma incapace di fissarsi alla membrana. Se l'esone e3 contiene la sequenza che codifica la parte di proteina complementare ad un ormone, entrambe le proteine lo legheranno ma la prima agirà da recettore, la seconda, libera nell'ambiente extracellulare, da inibitore ormonale (perché sottrarrà ai recettori l'ormone), quindi in modi completamente opposti.
Lo splicing, alternativo e non, è regolato da proteine che riconoscono sequenze specifiche e possono trovarsi sia negli introni che negli esoni. Le sequenze che permettono il riconoscimento dei siti di splicing sono chiamate exonic o intronic splicing enhancers (ESE o ISE) a seconda della loro localizzazione su esoni o introni, mentre le sequenze che mascherano tali siti sono chiamate exonic o intronic splicing silencers (ESS o ISS). Nella maggior parte dei casi le sequenze enhancer sono riconosciute da proteine della famiglia SR, mentre le sequenze silencer vengono riconosciute da proteine hnRNP.
Gli eventi di splicing alternativo sono dovuti alla differente capacità delle proteine di legare queste sequenze; questa capacità definisce anche la "forza" di riconoscimento di un sito di splicing. La selezione di un determinato sito di splicing (e quindi la possibilità di splicing alternativo) dipende non solo dalla presenza di ESE, ISE, ESS e ISS nella sequenza ma anche dalla disponibilità delle proteine che le legano.
Una classe di proteine molto importanti è quella delle proteine SR; queste sono ricche in arginina e serina e sono implicate nei processi di selezione dei siti di splicing sugli mRNA eucariotici. Queste proteine hanno due domini: un dominio RS ricco in arginina e serina; l'altro (RRM ossia RNA-recognition motif) è implicato nel riconoscimento dell'RNA.
Il dominio RS è soggetto alla fosforilazione della serina che sembra essere responsabile del reclutamento di altre proteine che controllano lo splicing. Il dominio RRM invece, sembra essere implicato nel riconoscimento di specifiche sequenze sull'mRNA che sono localizzate nell'esone.
Si conta che ogni gene umano dia vita, in media, a 4 proteine diverse. Questo meccanismo di saldatura alternativa spiega, in parte, perché negli organismi superiori non ci sia un rapporto lineare tra numero di geni e complessità dell'organismo (=numero di proteine), che dipende anche dalla capacità di utilizzare più o meno diffusamente il meccanismo dello splicing alternativo.
Un meccanismo simile è implicato nell'espressione dei geni per le immunoglobuline dei linfociti. In tal modo è possibile produrre un'enorme varietà di anticorpi. Meccanismi di splicing alternativo si possono ritrovare anche nella Drosophila melanogaster: è stato individuato sul gene sxl, che ne determina il sesso.
Eventi di splicing alternativo sembrano essere coinvolti nella variabilità genetica (anche tra individui della stessa specie) e nell'evoluzione.[3]
La regolazione dello splicing alternativo determina il sesso nella Drosophila melanogaster
[modifica | modifica wikitesto]I geni SisA e SisB, che si trovano sul cromosoma X, codificano per gli attivatori trascrizionali che controllano l'espressione del gene Sxl. Dpn, un repressore di Sxl, è codificato da un gene localizzato sul cromosoma 2. Sebbene sia i maschi che le femmine esprimano la stessa quantità di Dpn, le femmine sintetizzano una quantità di attivatori doppia rispetto al maschio (nella femmina ci sono due cromosomi X, mentre nel maschio solamente uno). La differenza fra la quantità dell'attivatore e quella del repressore assicura che Sxl venga espressa nella femmina e non nel maschio. La proteina Sex-lethal è quindi prodotta nei moscerini che si svilupperanno come femmine, ma non in quelli che si svilupperanno come maschi. La presenza di questa proteina è mantenuta grazie a un'autoregolazione dello splicing del suo mRna. In assenza di questa regolazione, non viene prodotta alcuna proteina (nel maschio). Sex-lethal controlla anche lo splicing del messaggero del gene tra, producendo una proteina funzionale nella femmina, ma non funzionale nel maschio. Tra è essa stessa un regolatore dello splicing che agisce su un pre-mRna trascritto dal gene double-sex (dsx). Quando l'mRna di dsx è sottoposto a un evento di splicing a opera di Tra, viene prodotta una proteina (nella femmina) contenente una sequenza di 30 amminoacidi all'estremità carbossi-terminale che la distingue dalla forma prodotta in assenza del regolatore Tra (nei maschi). La forma di Dsx che si trova nella femmina attiva i geni necessari per lo sviluppo della femmina e reprime quelli per lo sviluppo del maschio. La forma che si trova nel maschio contiene una sequenza di 150 amminoacidi all'estremità carbossi-terminale che reprime i geni necessari per lo sviluppo della femmina. La proteina Sxl agisce come repressore dello splicing legandosi alla pirimidina al sito di splicing 3'. La proteina Tra, al contrario, agisce come attivatore dello splicing; si lega a una sequenza enhancer che si trova in un esone dell'Rna di dsx.[4]
Modalità di splicing alternativo
[modifica | modifica wikitesto]
Sono generalmente riconosciute cinque modalità di splicing alternativo.[5][6][7][8]
- Salto dell'esone: in questo caso un esone può essere eliminato dal trascritto primario. Questa è la modalità più comune di splicing nel pre-mRNA dei mammiferi.
- Esone mutuamente esclusivo: solo uno di due esoni viene mantenuto nell'mRNA maturo, non entrambi.
- Sito di taglio alternativo 5' : viene usato un sito di taglio al 5' alternativo, cambiando l'estremità 3' dell'esone a monte.
- Sito di taglio alternativo 3' : viene usato un sito di taglio al 3' alternativo, cambiando l'estremità 5' dell'esone a valle.
- Introne trattenuto: i siti di taglio di un introne possono non essere riconosciuti. In questo caso l'introne non viene eliminato dal trascritto di mRNA. La differenza con il salto dell'esone sta nel fatto che la sequenza trattenuta non è fiancheggiata da introni. Se l'introne trattenuto si trova nella regione codificante, esso non deve alterare la cornice di lettura degli esoni. Se avviene il cambiamento di quest'ultima, esso potrebbe generare una proteina tronca o non funzionale.
Oltre a queste modalità primarie di splicing alternativo, ci sono altri due meccanismi principali con cui mRNA differenti possono essere generati da uno stesso gene, tramite promotori e siti di poliadenilazione multipli. L'uso di promotori multipli è descritto come un meccanismo di regolazione trascrizionale piuttosto che di splicing alternativo; data la presenza di più promotori, la trascrizione può iniziare in punti diversi e generare conseguentemente mRNA con esoni diversi al 5'. All'altro estremo, i siti di poliadenilazione multipli possono fornire differenti siti di terminazione al 3' della trascrizione. Questi meccanismi assieme allo splicing alternativo offrono maggiore varietà di mRNA derivato da un singolo gene.

Le modalità sovracitate di splicing sono di base, ma possono essere inadeguate per descrivere gli eventi di splicing complessi. Per esempio, la figura a destra mostra 3 forme diverse di splicing per il gene della ialuronidasi 3 del topo. Comparando la prima struttura esonica mostrata in figura (verde) con la seconda (gialla) si evidenzia la ritenzione di un introne, mentre il confronto tra il secondo e il terzo messaggero (gialla vs blu), mostra skipping dell'esone. È stato recentemente proposto un modello di nomenclatura per designare in modo univoco tutti i modelli possibili di giunzione.[8]
Errori nello splicing
[modifica | modifica wikitesto]Mutazioni negli introni o negli esoni possono rendere impossibile la saldatura e ciò comporta un'alterazione nella sintesi proteica.
Errori comuni:
- Mutazione di un sito di saldatura e conseguente perdita della funzione del sito. Si traduce nella comparsa prematura di un codone di stop sull'esone, nella perdita di un esone, o nell'inclusione di un introne nell'RNA maturo.
- Mutazione di un sito di saldatura che ne riduce la specificità. Può causare lo spostamento del sito di saldatura, e dunque l'inserimento o la delezione di alcuni amminoacidi, o più frequentemente, la perdita del quadro di lettura.
- Trasposizione di un sito di saldatura. Verranno incluse nell'RNA maturo più o meno basi rispetto alla norma. Gli esoni risulteranno, dunque, più corti o più lunghi.
Note
[modifica | modifica wikitesto]- ^ Michael M. Cox e David L. Nelson, I principi di biochimica di Lehninger.
- ^ Auinash Kalsotra, Functional consequences of developmentally regulated alternative splicing, in Nature Reviews Genetics, vol. 12, n. 10, 2011, pp. 715-729, DOI:10.1038/nrg3052, PMID 21921927.
- ^ H Keren, Alternative splicing and evolution: diversification, exon definition and function, in Nature Reviews Genetics, vol. 11, n. 5, 2010, pp. 345-355, DOI:10.1038/nrg2776, PMID 20376054.
- ^ James Watson, Backer, Bell, Gann, Levine, Losick, Biologia molecolare del gene, Zanichelli, 2015, p. 503, ISBN 978-88-08-36480-7.
- ^ Douglas L. Black, Mechanisms of alternative pre-messenger RNA splicing, in Annual Reviews of Biochemistry, vol. 72, n. 1, 2003, pp. 291–336, DOI:10.1146/annurev.biochem.72.121801.161720, PMID 12626338.
- ^ Q Pan, Shai O, Lee LJ, Frey BJ, Blencowe BJ, Deep surveying of alternative splicing complexity in the human transcriptome by high-throughput sequencing, in Nature Genetics, vol. 40, n. 12, dicembre 2008, pp. 1413–1415, DOI:10.1038/ng.259, PMID 18978789.
- ^ AJ Matlin, Clark F, Smith, CWJ, Understanding alternative splicing: towards a cellular code, in Nature Reviews, vol. 6, n. 5, maggio 2005, pp. 386–398, DOI:10.1038/nrm1645, PMID 15956978.
- ^ a b Michael Sammeth, Sylvain Foissac; Roderic Guigó, A general definition and nomenclature for alternative splicing events, in Michael R. Brent (a cura di), PLoS Comput Biol., vol. 4, n. 8, 2008, pp. e1000147, DOI:10.1371/journal.pcbi.1000147, PMC 2467475, PMID 18688268.
Bibliografia
[modifica | modifica wikitesto]- James Watson, Backer, Bell, Gann, Biologia molecolare del gene, Zanichelli, 2009, ISBN 978-88-08-16412-4.
- James Watson, Backer, Bell, Gann, Levine, Losick, Biologia molecolare del gene, Zanichelli, 2015, ISBN 978-88-08-36480-7.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Splicing
Wikimedia Commons contiene immagini o altri file su Splicing
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) RNA splicing, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.










