Ribosoma

I ribosomi sono complessi macromolecolari, immersi nel citoplasma o ancorati al reticolo endoplasmatico ruvido o contenuti in altri organuli (mitocondri e cloroplasti), responsabili della sintesi proteica. La loro funzione è di leggere le informazioni contenute nella catena di RNA messaggero (m-RNA). Sono organuli privi di membrana.
Furono messi in evidenza nel 1953 al microscopio elettronico dal biologo rumeno George Emil Palade[1], scoperta che gli valse il Premio Nobel. Il termine ribosoma fu invece proposto nel 1958 da Richard B. Roberts[2].
Struttura
[modifica | modifica wikitesto]
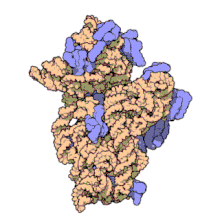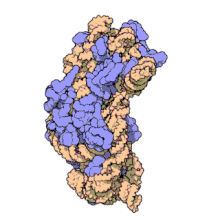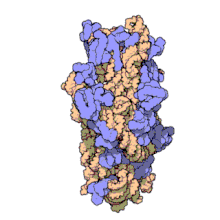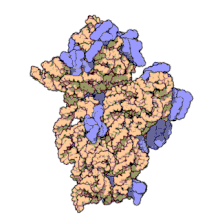
I ribosomi vengono sintetizzati nel nucleolo. Sono formati da quattro molecole di RNA ribosomiale e da proteine che si associano a formare due subunità di dimensioni differenti. I ribosomi dei batteri, degli archea e degli eucarioti differiscono sensibilmente tra loro sia per la struttura sia per le sequenze di RNA.
Un ribosoma batterico ha una massa di circa 2700 kDa, un diametro di circa 20nm e un coefficiente di sedimentazione di 70 S.
Esso si può suddividere in due parti o subunità, una più grande e una più piccola:
- una subunità grande di 50 S avente almeno 34 proteine (L1-L34) e due molecole di RNA (23 S e 5 S),
- una subunità piccola di 30 S contenente almeno 21 proteine (S1-S21) e un RNA di 16 S.
Invece il ribosoma della cellula eucariota, fatta eccezione per quelli contenuti nei mitocondri detti mitoribosomi e nei cloroplasti, che è di 70 S come nei procarioti, è più grande e ha una massa molecolare di 4000 kDa, un diametro di 23 nm e un coefficiente di sedimentazione di 80 S.
Anch'esso è composto da due subunità, maggiore di 60 S e minore di 40 S:
- la subunità maggiore è costituita da tre molecole di rRNA, una a 28 S, una a 5,8 S, un'ultima a 5 S e circa 45 proteine.
- la minore consta di una sola catena di rRNA 18 S e da 33 proteine.
Nel complesso si arriva a circa 80 proteine.
Le singole molecole di rRNA, tranne la 5 S, vengono sintetizzate nei nucleoli come RNA 45 S. Il DNA contenuto nel nucleolo viene trascritto dalla RNA polimerasi I a partire da più punti della catena di DNA, in strutture (i cistroni) che vengono dette ad "albero di Natale": il tronco verrebbe rappresentato dal DNA, i rami dalle molte catene di rRNA che vengono trascritte nello stesso momento. rRNA 45 S appena trascritto è detto pre-rRNA; in seguito a tagli, esso darà origine a rRNA 18 S per la subunità minore del ribosoma e 32 S, che verrà tagliato ulteriormente in 28 S e 5,8 S. Nel pre-rRNA sono presenti pseudouridine e basi azotate metilate. Si pensa che la funzione di queste modifiche nelle basi sia di evitare il taglio enzimatico, o favorire le interazioni dell'RNA interne alla catena o con altre molecole.
Disposizione
[modifica | modifica wikitesto]La loro disposizione all'interno della cellula varia a seconda del tipo di cellula, ed è collegata alla funzione di quest'ultima:
- se la cellula secerne le proteine prodotte, possiede solo ribosomi attaccati al reticolo endoplasmatico, che occupa gran parte del citosol, e alla membrana nucleare;
- se la cellula immagazzina queste proteine, possiede ribosomi liberi nel citoplasma.
I ribosomi liberi
[modifica | modifica wikitesto]Sono così denominati i ribosomi che si trovano liberi nel citoplasma o che fanno parte dei mitocondri o dei cloroplasti. Generalmente sono deputati alla sintesi di proteine che verranno rilasciate e utilizzate nel citoplasma o nella parte interna della membrana degli organuli ove i ribosomi sono presenti e anche nei perossisomi. Più ribosomi sono in grado di unirsi tra loro utilizzando come legame una stessa molecola di RNA messaggero, attraverso la quale si muovono dal codone iniziale fino a quello finale in direzione 3', a formare un poliribosoma (o polisoma).
I ribosomi legati alle membrane
[modifica | modifica wikitesto]Si trovano legati alle membrane costituenti il nucleo cellulare o il reticolo endoplasmatico ruvido. Si occupano di sintetizzare e rilasciare proteine all'interno delle membrane di queste strutture, dove poi saranno condotte alla loro destinazione finale che può essere intra- o extracellulare, nel qual caso vengono spesso espulse per esocitosi. I ribosomi adesi alle membrane sono una sezione dell'insieme dei ribosomi liberi, sezione che viene poi reclutata non appena iniziano a sintetizzare proteine specifiche.
Processo di traduzione
[modifica | modifica wikitesto]Le due subunità del ribosoma si uniscono tra loro e operano insieme per tradurre un RNA messaggero in una catena polipeptidica durante la sintesi proteica. La parte più importante del ribosoma, sotto quest'aspetto, sono le molecole di RNA ribosomiale che da sole sono in grado, seppur lentamente, d'operare il processo di traduzione, comportandosi da ribozima. Questo lascia ipotizzare che la componente proteica agisca in modo tale da potenziare e velocizzare l'azione dell'RNA ribosomiale.
Prima che le subunità si uniscano insieme per incominciare a tradurre la molecola di mRNA, vi è la necessità che il complesso di pre-inizio si leghi alla subunità inferiore; a questo punto il ribosoma si può collegare alla molecola dell'RNA messaggero, e una volta che la subunità minore riconosce la tripletta di inizio, si staccano i fattori di pre-inizio, le due subunità si collegano e il ribosoma può incominciare a sintetizzare la proteina. La subunità superiore è composta da tre siti, in ordine: sito A (amminoacidico), P (peptididico) e sito E ("exit", di uscita). Si ricordi che la subunità inferiore possiede solo un sito d'attacco predisposto per l'mRNA.
Il primo RNA transfer (tRNA) si va a inserire nel sito A, a questo punto arriva un secondo tRNA il quale si andrà a posizionare nel sito P. Ora il ribosoma scorre di una tripletta, portando gli amminoacidi tradotti dal sito A, a legarsi nel sito P. La tripletta codificata da P a questo punto passa al sito E, dove verrà rilasciato. In sintesi:
- Il sito A è il sito che attende l'arrivo di nuove triplette da codificare;
- Il sito P tiene salda la sequenza polipeptidica, rilasciandola solamente quando il sito A ha tradotto un ulteriore amminoacido;
L'ipotesi del segnale
[modifica | modifica wikitesto]I ribosomi liberi e quelli legati alle membrane sintetizzano due classi di proteine tra loro differenti. Come può la cellula operare una simile distinzione? L'ipotesi del segnale, sviluppata nel 1971, afferma che l'informazione che permette di operare questo processo è contenuta nella sezione N-terminale della catena polipeptidica, che è la prima a emergere dal ribosoma. Successivamente a quest'ipotesi si sono aggiunti dei dati di supporto che permisero di arrivare al seguente modello.
Il filamento di RNA messaggero da tradurre arriva al ribosoma che in quel momento è libero e contenuto nel citoplasma. Una volta iniziata la traduzione, nella parte N-terminale (anche se in alcuni polipeptidi è più interna) è contenuta una sequenza di 6-20 amminoacidi non polari. Questa sequenza viene riconosciuta da una particella di riconoscimento del segnale (SRP), una struttura formata da una molecola di RNA (RNA 7SL) e 6 catene polipetidiche, che vi si lega e blocca il suo prematuro ripiegamento e la continuazione della sintesi proteica. Ciò fa sì che il ribosoma arrivi alle membrane del reticolo endoplasmatico rugoso, invece di completare la traduzione della proteina che altrimenti sarebbe rilasciata nel citoplasma. La particella di riconoscimento del segnale legata agisce come un ligando che va a legarsi a due recettori che si trovano sulla membrana citoplasmatica del reticolo endoplasmatico, uno per la SRP e l'altro per il ribosoma. Per creare il legame tra SRP e il suo recettore è necessario che a SRP si leghi una molecola di guanosina trifosfato (GTP). Successivamente l'SRP viene staccata dalla sequenza segnale e poi dal ribosoma, per idrolisi del GTP in guanosina difosfato (GDP) mentre la sequenza segnale va a legarsi a una sezione d'un canale proteico transmembrana. Essendosi staccato l'SRP il ribosoma riprende la sintesi proteica, ma la catena polipeptidica viene traslocata attraverso il canale e penetra nel reticolo endoplasmatico (traslocazione). Successivamente la sequenza segnale viene tagliata da un enzima proteolitico, la peptidasi del segnale, e il resto della proteina viene sottoposta ad appositi processi di ripiegamento e di formazione di legami disolfuro.
Note
[modifica | modifica wikitesto]Bibliografia
[modifica | modifica wikitesto]- Pasqua G., Abbate G., Forni C., Botanica generale e diversità vegetale, Ed. PICCIN, 2007
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikizionario contiene il lemma di dizionario «ribosoma»
Wikizionario contiene il lemma di dizionario «ribosoma» Wikimedia Commons contiene immagini o altri file sul ribosoma
Wikimedia Commons contiene immagini o altri file sul ribosoma
Collegamenti esterni
[modifica | modifica wikitesto]- ribosoma, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- (EN) ribosome, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- (EN) IUPAC Gold Book, "ribosomes", su goldbook.iupac.org.
- (EN) Nature Structural & Molecular Biology: SRP meets the ribosome, su nature.com.
- Ribosoma, in Treccani.it – Enciclopedie on line, Roma, Istituto dell'Enciclopedia Italiana.
| Controllo di autorità | Thesaurus BNCF 58308 · LCCN (EN) sh85113856 · GND (DE) 4127731-4 · BNF (FR) cb12254742n (data) · J9U (EN, HE) 987007536325205171 · NDL (EN, JA) 00569445 |
|---|








