Indice
Tetracloruro di zirconio
| Tetracloruro di zirconio | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Tetracloruro di zirconio, cloruro di zirconio(IV) | |
| Caratteristiche generali | |
| Formula bruta o molecolare | ZrCl4 |
| Massa molecolare (u) | 233,04 |
| Aspetto | solido bianco |
| Numero CAS | |
| Numero EINECS | 233-058-2 |
| PubChem | 24817 e 9856075 |
| SMILES | Cl[Zr](Cl)(Cl)Cl |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 2,80[1] |
| Solubilità in acqua | reagisce |
| Temperatura di ebollizione | 331 °C (604 K) (sublima)[2] |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | -980,5[2] |
| ΔfG0 (kJ·mol−1) | -889,9[2] |
| S0m(J·K−1mol−1) | 181,6[2] |
| C0p,m(J·K−1mol−1) | 119,8[2] |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 1690 oral rat[1] |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 
| |
| pericolo | |
| Frasi H | 302 - 314 [1] |
| Consigli P | 280 - 301+330+331 - 305+351+338 - 309+310 [1] |
Il tetracloruro di zirconio è il composto binario con formula ZrCl4. In condizioni normali si presenta come polvere bianca volatile che si idrolizza rapidamente con l'umidità dell'aria.[3] Il composto è disponibile in commercio ed è usato principalmente come catalizzatore in sintesi organica e come precursore per la sintesi di altri composti di zirconio. È inoltre un importante intermedio nella produzione dello zirconio metallico tramite il processo Kroll.[4]
Struttura
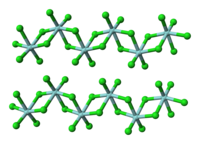
[modifica | modifica wikitesto]In fase gassosa il tetracloruro di zirconio è presente come molecola ZrCl4 con struttura tetradraedica, analogamente a TiCl4 e HfCl4.[5][6] Allo stato solido invece il composto ha struttura polimerica con catene di ottaedri distorti connessi tra loro (vedi figura). La stessa struttura polimerica è presente anche nel congenere superiore HfCl4.[3]
Sintesi
[modifica | modifica wikitesto]Il tetracloruro di zirconio viene normalmente prodotto trattando zirconia con carbonio e cloro. La reazione va condotta con totale esclusione di aria; la funzione del carbonio è di catturare l'ossigeno:[6][7]
Si può preparare anche facendo reagire zirconio metallico con cloro o cloruro di idrogeno.[6]
Su scala di laboratorio si può usare tetracloruro di carbonio in sostituzione di carbonio e cloro:[8]
Proprietà
[modifica | modifica wikitesto]Il tetracloruro di zirconio è molto sensibile all'acqua e va utilizzato in atmosfera priva di umidità. A contatto con aria umida rilascia fumi di acido cloridrico. In acqua reagisce velocemente formando l'ossicloruro e acido cloridrico:[4]
In soluzione basica si forma l'idrossido:[4]
Il tetracloruro di zirconio è solubile in etanolo ed etere.[4]
Riscaldato sotto vuoto a 400 ºC assieme a cloruro d'ammonio forma esaclorozirconato(IV) d'ammonio, (NH4)2ZrCl6. La formazione di esaclorozirconati avviene anche con cloruri dei metalli alcalini o alcalino-terrosi.[6][9]
Applicazioni
[modifica | modifica wikitesto]Il tetracloruro di zirconio è usato nella fabbricazione degli elettrodi di zirconia delle celle a combustibile,[6] e come materiale di partenza per la sintesi di composti organometallici di zirconio,[10] come ad esempio il dicloruro di zirconocene ZrCl2(C5H5)2, un complesso molto versatile.[11] In sintesi organica il tetracloruro di zirconio è usato come acido di Lewis debole in varie sintesi, tra cui le reazioni di Friedel-Crafts, di Diels-Alder e di ciclizzazione intramolecolare.[12] È inoltre impiegato nella fabbricazione di idrorepellenti per tessuti e altri materiali fibrosi, ed è un importante intermedio nella produzione dello zirconio metallico nel processo Kroll.[4]
Note
[modifica | modifica wikitesto]Bibliografia
[modifica | modifica wikitesto]- (EN) U. Bora, Zirconium Tetrachloride, in Synlett, vol. 2003, n. 7, 2003, pp. 1073-1074, DOI:10.1055/s-2003-39323.
- (EN) G. Brauer, Handbook of preparative inorganic chemistry, vol. 2, 2ª ed., New York, Academic Press, 1965.
- GESTIS, Zirconium(IV) chloride, su gestis-en.itrust.de. URL consultato il 21 febbraio 2018. Pagina del tetracloruro di zirconio nel data base GESTIS.
- (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- (EN) W. S. Hummers, S. Y. Tyree Jr. e S. Yolles, Zirconium and Hafnium Tetrachlorides, in Inorg. Synth., vol. 4, 1953, p. 121, DOI:10.1002/9780470132357.ch41.
- (EN) C. M. Kozak e P. Mountford, Zirconium & Hafnium: Inorganic & Coordination Chemistry, in Encyclopedia of Inorganic Chemistry, 2ª ed., John Wiley & Sons, 2006, DOI:10.1002/0470862106.ia263, ISBN 9780470862100.
- D. R. Lide (Editor), CRC Handbook of Chemistry and Physics, Internet Version 2005, su hbcponline.com, CRC Press, Boca Raton, 2005. URL consultato il 9 dicembre 2017.
- (EN) I. Marek, New Aspects of Zirconium Containing Organic Compounds, in Topics in Organometallic Chemistry, vol. 10, 2005, DOI:10.1007/b80198.
- (EN) R. Nielsen, Zirconium and zirconium compounds, in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 2002, DOI:10.1002/14356007.a28_543.
- (EN) M. Ohashi, S. Yamanaka, Y. Morimoto e M. Hattori, Preparation and Properties of Ammonium Hexachlorozirconate(IV) and Its Reaction with Gaseous Ammonia, in Bull. Chem. Soc. Jpn., vol. 60, n. 7, 1987, pp. 2387-2390, DOI:10.1246/bcsj.60.2387.
- (EN) P. Patnaik, Handbook of inorganic chemicals, New York, McGraw-Hill, 2003, ISBN 0-07-049439-8.
- (EN) G. Wilkinson e J. M. Birmingham, Bis-cyclopentadienyl Compounds of Ti, Zr, V, Nb and Ta, in J. Am. Chem. Soc., vol. 76, n. 17, 1954, pp. 4281-4284, DOI:10.1021/ja01646a008.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su tetracloruro di zirconio
Wikimedia Commons contiene immagini o altri file su tetracloruro di zirconio










![{\displaystyle {\ce {ZrO2\ +\ 2C\ +\ 2Cl2->[{\text{700 °C}}]ZrCl4\ +\ 2CO}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b148dff2606c21fc89862e4db1dd3186639dc488)


