Indice
Arsenozuccheri

Gli arsenozuccheri sono composti organici costituiti da 3 diverse parti:[1]
- un nucleo 5-deossipentoso;
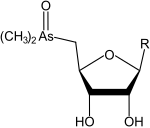
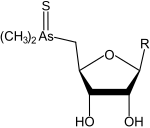
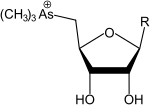
- un gruppo arsinoile (–AsR2(=O)), arsinotioile (–AsR2(=S)) o arsonio (-As+R3) legato al carbonio 5 dell'anello. In questo gruppo l'arsenico può essere trivalente o pentavalente, può essere legato a un atomo di ossigeno (ossoarsenozuccheri), a un atomo di zolfo (tioarsenozuccheri) e/o a più gruppi metilici (arsinoile dimetilato se 2, arsonio trimetilato se 3);
- una catena legata al carbonio 1 dell'anello, che può essere costituita da gruppi funzionali molto variegati.
Gli arsenozuccheri più comuni sono gli ossoarsenozuccheri dimetilati con arsenico pentavalente, e in particolare i 4 principali sono gli arsenozuccheri glicerolo, fosfato, solfato e solfonato.[1]
Questi composti costituiscono la forma prevalente di arsenico nelle alghe, ma sono presenti anche nei molluschi erbivori e nei gasteropodi in quantità significative.[2]
Nomenclatura
[modifica | modifica wikitesto]Poiché la struttura degli arsenozuccheri è relativamente complessa, i loro nomi IUPAC sono molto lunghi e poco pratici. Per questo in letteratura sono stati fatti dei tentativi di nomenclatura abbreviata, ma non ne esiste uno ufficiale.
Negli anni ottanta i giapponesi Morita e Shibata[3][4] cominciarono ad usare dei numeri romani per identificare gli arsenozuccheri (insieme ad altre specie dell'arsenico); tale convenzione è stata poi seguita da altri autori.[5] Nel 1994 Kevin Francesconi[5] propose che i 4 arsenozuccheri principali venissero denominati con un nome comune che, benché non propriamente esatto da un punto di vista chimico, potesse identificare la loro principale caratteristica strutturale: ancora oggi tali composti sono chiamati arsenozucchero glicerolo, fosfato, solfato e solfonato.
Nel 2005, per la prima volta, venne proposto un sistema di nomenclatura più generale. In un loro articolo pubblicato su Analytical Chemistry,[6] Nischwitz e Pergantis utilizzarono delle abbreviazioni contenenti le principali informazioni strutturali dei composti:
- il numero di gruppi metilici legati all'arsenico: "DM" (dimethyl) o "TM" (trimethyl);
- se l'arsenico è legato a un atomo di zolfo si aggiunge "thio";
- il nucleo arsenoribofuranosidico si indica con "AsSugar" (ma può essere omesso se nel contesto si sta parlando solo di arsenozuccheri);
- infine, si aggiunge un nome corrispondente al gruppo funzionale caratteristico della catena laterale legata al carbonio 1 dell'anello ("Sulfate", "Sulfonate" ecc.).
Ad esempio, l'arsenozucchero trimetilato 3-[5'-deoxy-5'-(trimethylarsonio)-β-ribofuranosyloxy]-2-hydroxypropylene glycol con queste convenzioni viene chiamato semplicemente TMAsSugarGlycerol.
Infine, nel 2011 Jörg Feldmann[2] distinse tra AsIII, AsV e arsonio usando rispettivamente le forme DMAIII-sugar-nome (es. DMAIII-sugar-glycerol), DMAV-sugar-nome (es. DMAV-sugar-glycerol) o TMA-sugar-nome (es. TMA-sugar-glycerol).
Lista di arsenozuccheri
[modifica | modifica wikitesto]Vengono elencati tutti gli arsenozuccheri scoperti fino ad oggi, riportando il nome comune secondo la nomenclatura proposta da Nischwitz e Pergantis[6], il nome completo e i riferimenti bibliografici (della prima scoperta del composto o del nome usato).
Ossoarsenozuccheri dimetilati
[modifica | modifica wikitesto]| R | Nome comune | Nome completo | Rif. |
|---|---|---|---|
| DMAsSugarGlycerol | 3-[5'-deoxy-5'-(dimethylarsinoyl)-β-ribofuranosyloxy]-2-hydroxypropylene glycol | [1][7] | |

|
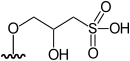
DMAsSugarPhosphate | 3-[5'-deoxy-5'-(dimethylarsinoyl)-β-ribofuranosyloxy]-2-hydroxypropyl 2,3-hydroxypropyl phosphate | [1][7] |
|
DMAsSugarSulfonate | 3-[5'-deoxy-5'-(dimethylarsinoyl)-β-ribofuranosyloxy]-2-hydroxypropanesulfonic acid | [1][7] |

|
DMAsSugarSulfate | 3-[5'-deoxy-5'-(dimethylarsinoyl)-β-ribofuranosyloxy]-2-hydroxypropyl hydrogen sulfate | [1][7] |

|
DMAsSugarAminoSulfonate | 2-amino-3-[5-deoxy-5-(dimethylarsinoyl)-β-D-ribofuranosyloxy]propene-1-sulphonic acid | [1][8] |
| DMAsSugarHydroxy | 5-dimethylarsinoyl-β-ribofuranosol | [1][9] | |
| DMAsSugarMethoxy | methyl 5-deoxy-5-(dimethylarsinoyl)-β-D-riboside | [1][10] | |

|
DMAsSugarCarboxyl | 3-(5'-deoxy-5'-dimethylarsinoyl-β-D-ribosyloxy)-2-hydroxypropanoic acid | [1][11] |

|
DMAsSugarCarbamate | N-(5'-deoxy-5'-dimethylarsinoyl-β-D-ribosyloxycarbonyl) glycine | [1][11] |

|
DMAsSugarMannitol | 1-O-[5'-deoxy-5'-(dimethylarsinoyl)-β-D-ribosyl]mannitol | [1][10] |

|
DMAsSugarAdenine | 5'-dimethylarsinoyl-adenosine | [6][11] |

|
DMAsSugarCarboxyl-2 | 2-[5-deoxy-5-(dimethylarsinoyl)-β-ribofuranosyloxy]-acetic acid | [9][12] |
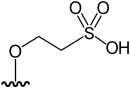
|
DMAsSugarSulfonate-2 | 2-[5-deoxy-5-(dimethylarsinoyl)-β-ribofuranosyloxy]-ethan sulfonic acid | [12] |
|
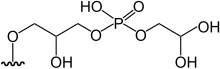
3-[5'-deoxy-5'-(dimethylarsinoyl)-β-ribofuranosyloxy]-2-hydroxypropyl 2,di-hydroxyethyl phosphate | [9] | |

|
[10][13] | ||
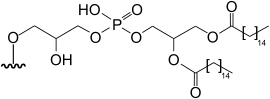
|
dipalmitoylglycerophospho-2-hydroxypropyl-5-deoxy-5-(dimethylarsinoyl)-β-ribofuranoside | [13][14] |
Tioarsenozuccheri dimetilati
[modifica | modifica wikitesto]| R | Nome comune | Nome completo | Rif. |
|---|---|---|---|
| DMThioAsSugarGlycerol | [6] | ||

|
DMThioAsSugarPhosphate | [6] | |

|
DMThioAsSugarSulfonate | [6][15] | |

|
DMThioAsSugarSulfate | [6][15] |
Arsenozuccheri trimetilati
[modifica | modifica wikitesto]| R | Nome comune | Nome completo | Rif. |
|---|---|---|---|
| TMAsSugarGlycerol | 3-[5'-deoxy-5'-(trimethylarsonio)-β-ribofuranosyloxy]-2-hydroxypropylene glycol | [6][16] | |

|
TMAsSugarSulfate | 3'-[5-deoxy-5-(trimethylarsonio)-β-D-ribosyloxy]-2'-hydroxypropyl sulphate | [6][10] |

|
TMAsSugarPhosphate | 3-[5'-deoxy-5'-(trimethylarsonio)-β-ribofuranosyloxy]-2-hydroxypropyl 2,3-hydroxypropyl phosphate | [6] |

|
TMAsSugarSulfonate | 3-[5'-deoxy-5'-(trimethylarsonio)-β-ribofuranosyloxy]-2-hydroxypropanesulfonic acid | [6] |

|
TMAsSugarAminoSulfonate | [17] | |
| TMAsSugarHydroxy | 5-trimethylarsonio-β-ribofuranose | [1][9] | |
| TMAsSugarMethoxy | methyl-(5-deoxy-5-trimethylarsonio)-β-ribofuranoside | [12] |
Altri arsenozuccheri
[modifica | modifica wikitesto]| R | Nome completo | Rif. |
|---|---|---|
| methyl 5-deoxy-5-(dimethylarsinoyl)-2,3-O-isopropylidene-β-D-riboside | [10] | |

|
2',3'-isopropylidenedioxypropyl 5-deoxy-5-dimethyl-arsinoyl-2,3-O-isopropylidene-β-D-riboside | [11] |
| 2',3'-dihydroxypropyl 5-deoxy-5-dimethylarsinoyl-2,3-O-isopropylidene-β-D-riboside | [11] | |

|
2',3'-isopropylidenedioxypropyl 5-deoxy-5-dimethylarsinoyl-2,3-O-isopropylidene-β-D-riboside | [11] |
| R | Nome completo | Rif. |
|---|---|---|

|
[14][18] | |
| dimethyl (methyl-2,3-O-isopropylidene-5-deoxy-β-D-ribofuranose-5-yl) arsine | [19] |
Ci sono infine degli arsenozuccheri particolari che non rientrano in nessuna delle categorie mostrate precedentemente.
| Immagine | Nome completo | Rif. |
|---|---|---|
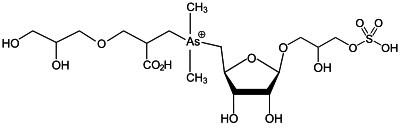
|
[10] | |
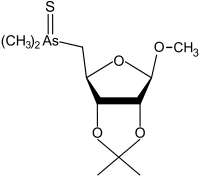
|
methyl-2,3-O-isopropylidene-5-deoxy-5-dimethyl-thioarsinoyl-β-D-ribofuranoside | [19] |

|
5-dimethylarsinoyl-β-ribofuranose
(Francesconi nella sua review del 2004[5] contesta questo nome, suggerendo che il composto «potrebbe anche essere considerato un diidrossifurano sostituito»; ciò è confermato dalla review di Niegel del 2010,[1] che lo definisce un «derivato degli arsenozuccheri» chiamandolo «dimethylarsinoyldihydroxyfuran») |
[20] |
Distribuzione
[modifica | modifica wikitesto]
Gli arsenozuccheri sono presenti principalmente nelle alghe (circa il 78% della frazione di arsenico), e costituiscono una frazione significativa dell'arsenico anche nei molluschi marini e nei gasteropodi (circa 23%); viceversa, sono presenti in bassissime concentrazioni nei pesci e nel riso.[2] Sono stati trovati anche in organismi terricoli (licheni, funghi, lombrichi e alcune specie di piante), ma in generale quelli marini contengono una maggiore quantità di questi composti rispetto a quelli terricoli o di acqua dolce.[1]
La loro concentrazione varia dalle tracce (ad esempio tutti i trimetil arsonio arsenozuccheri[2]) ai µg/g;[1] in generale la loro distribuzione e concentrazione nelle alghe marine dipende fortemente dalla classe tassonomica: l'arsenozucchero glicerolo e il solfonato, ad esempio, vennero isolati per la prima volta nel 1981 dall'alga bruna Ecklonia radiata.[21] mentre nell'alga bruna Hizikia fusiforme l'arsenozucchero solfato è stato determinato quale principale composto dell'arsenico.[8] Infine, nelle alghe rosse (Rhodophyta) e nelle alghe verdi (Chlorophyta) gli arsenozuccheri più presenti sono il glicerolo e il fosfato.[22]
Caratteristiche fisiche e chimiche
[modifica | modifica wikitesto]Le molecole degli arsenozuccheri hanno in generale un carattere cationico e polare a causa del gruppo (CH3)2As=O, e per questo sono solubili in acqua (ad eccezione del derivato dipalmitoile dell'arsenozucchero fosfato[13]).[1] Le loro proprietà acide dipendono però quasi esclusivamente dall'aglicone,[1] e per i 4 arsenozuccheri principali l'ordine di acidità è il seguente: solfato > solfonato > fosfato > glicerolo (che non contiene un gruppo acido).[23] Sono caratterizzati da una relativamente bassa stabilità chimica (inferiore rispetto all'arsenobetaina), e la loro degradazione avviene preferibilmente in un ambiente acido o che stimola quello gastrico (probabilmente favorita da attività enzimatica o microbica).[1]
I tioarsenozuccheri sono meno polari[24] e meno stabili[1] degli ossoarsenozuccheri.
Metabolismo e tossicità
[modifica | modifica wikitesto]
Si pensa che gli arsenozuccheri vengano sintetizzati negli organismi marini a partire dall'arsenico inorganico (assunto dall'acqua di mare) attraverso processi di alchilazione ossidativa come meccanismo di detossificazione:[25][26] questo sembra essere vero solo in presenza di un basso contenuto di arsenico, mentre ad alte concentrazioni si formano anche monometilarsonato (MA) e dimetilarsinato (DMA), e a concentrazioni molto alte (100 µg As l−1) si ha un accumulo di arsenico tossico per un cessato funzionamento dei processi di detossificazione.[27] Può anche accadere che un passaggio intermedio tra l'arsenico inorganico e gli arsenozuccheri sia la formazione di arsenolipidi.[26][28] Infine, alla morte delle alghe, si ha la conversione ad arseniato e DMA degli arsenozuccheri.[29]
Per quanto riguarda lo studio del metabolismo di questi composti negli esseri umani, il problema principale consiste nella grande variabilità di comportamento nei diversi individui.[2][26] Lo studio di tossicità degli arsenozuccheri è di grande interesse per l'elevato uso alimentare delle alghe, specialmente nei paesi asiatici:[30] in Giappone, ad esempio, il consumo di alghe può portare ad un'assunzione di circa 1 mg di arsenico al giorno[31] (le alghe contengono una quantità di arsenico pari a circa 100 mg su kg di peso secco[30]), laddove la dose giornaliera tollerata di arsenico stabilita dalle linee guida dell'Organizzazione mondiale della sanità è di 0,002 mg per chilo di peso corporeo (quindi circa 0,15 mg per una persona di 75 kg).[32] Tuttavia, ad oggi non ci sono informazioni definitive sulla tossicità di questi composti,[1] che non sono quindi contemplate singolarmente dall'Autorità europea per la sicurezza alimentare.[33] L'arsenozucchero glicerolo risulta non avere citotossicità,[34][35] mentre gli arsenozuccheri con arsenico trivalente presentano generalmente un'attività citotossica superiore agli arsenozuccheri con arsenico pentavalente,[30] ma non è stato ancora possibile trarre una conclusione generale sull'intera classe di composti.[2]
In generale non si sono rilevate quantità significative di arsenozuccheri nelle urine umane dopo ingestione di alghe[36] o di campioni sintetici di questi composti,[37] quindi si sa che vengono metabolizzati. I metaboliti identificati sono principalmente DMA, ma anche MA e DMAE (dimetilarsinoiletanolo),[36][37] attraverso trasformazioni metaboliche sconosciute a partire dai dimetilossoarsenozuccheri (alcuni passaggi sono stati proposti da Feldmann nel 2011[2]), e nel processo si possono anche verificare delle riduzioni a specie di arsenico trivalente o delle tiolazioni dell'ossigeno dell'arsenogruppo. Il DMA è noto avere una tossicità superiore a quella degli arsenozuccheri,[2] e anche le forme ridotte e tiolate sono potenzialmente più tossiche in quanto sono in grado di legarsi ai gruppi solfidrili di proteine e peptidi.[38] Inoltre, i metaboliti principali (DMA, MA e DMAE) coincidono con quelli derivanti dall'arsenico inorganico, avendo quindi un effetto simile; per questo motivo, gli arsenozuccheri vengono considerate come specie potenzialmente tossiche[2][26] (nonostante, come afferma Francesconi, «i dati limitati sulla tossicità degli arsenozuccheri ad oggi indicano una bassa tossicità»[26]).
Sono stati effettuati anche degli studi sui possibili effetti cancerogeni di queste sostanze analizzando le urine di pecore con dieta a base di alghe (animali che possiedono un metabolismo per questi composti simile a quello umano, dato che sono stati identificati gli stessi metaboliti trovati nelle urine umane): pur non riscontrando problemi di salute particolari in questi individui, la loro vita relativamente breve (4-6 anni) non rende comunque possibile valutare il rischio di cancro dovuto agli arsenozuccheri.[2]
Metodi di determinazione
[modifica | modifica wikitesto]
L'esigenza di studiare il metabolismo degli arsenozuccheri comporta la necessità di avere delle tecniche in grado di determinare questi composti,[1] riuscendo a distinguerli dalle numerose specie dell'arsenico presenti negli organismi marini (a concentrazioni molto varie), molte delle quali presentano proprietà chimiche e fisiche simili.[20]
L'assenza di standard o materiali di riferimento commerciali di questi composti complica ulteriormente l'analisi dei campioni.[1][20] Normalmente gli standard sono preparati per estrazione da campioni di alghe seguita da varie purificazioni cromatografiche; la sintesi chimica di alcuni ossoarsenozuccheri è tecnicamente possibile, ma lunga e complessa, mentre i tioarsenozuccheri e i trimetilarsenozuccheri vengono preparati a partire dai dimetilossoarsenozuccheri.[1]
Trattamento del campione
[modifica | modifica wikitesto]Non esiste una fase di trattamento del campione (pre-trattamento ed estrazione) codificata ufficialmente. Ci può essere (benché non necessario) un pre-trattamento che consiste in una delle seguenti procedure: congelamento e liofilizzazione; risciacquo dei campioni solidi con acqua Milli-Q, essiccamento, macinatura e omogeneizzazione; estrazione di campioni polverizzati con acetone; filtrazione e diluizione di campioni di urine.[1]
Tutte le procedure di trattamento del campione consistono comunque in un'estrazione:[1] la più usata è l'estrazione con solvente, che prevede l'impiego come solventi di acqua e metanolo (puri o in miscele), sfruttando la polarità di questi composti.[5] In caso di utilizzo di idrossido di tetrametilammonio o di idrossido di sodio, l'arsenozucchero solfato risulta più labile rispetto agli altri tre arsenozuccheri principali.[39] L'estrazione è accompagnata da sonicazione o agitazione meccanica ed è generalmente effettuata da 2 a 5 volte. Meno usate sono l'estrazione con microonde (è una tecnica molto aggressiva e comporta il rischio di degradazione o alterazioni dei composti) e l'estrazione accelerata con solvente (che ha il vantaggio di essere semi-automatica).[40][41] Nessuna di queste estrazioni è quantitativa; per migliorare quest'aspetto sono stati proposti dei «metodi chimico-enzimatici per degradare la struttura di cellulosa dell'alga» a cui sono legati gli arsenozuccheri.[40]
In pochi casi l'estrazione è seguita da un ulteriore passaggio di purificazione, tramite estrazione in fase solida, cromatografia off-line o l'utilizzo di pre-colonne prima dell'analisi cromatografica vera e propria.[1]
Analisi strumentale
[modifica | modifica wikitesto]L'analisi strumentale dei campioni per la determinazione degli arsenozuccheri consiste nell'accoppiamento di una tecnica separativa per discriminare le diverse specie dell'arsenico (cromatografia liquida) e un rivelatore dotato di buona specificità e sensibilità.[1]
Per quanto riguarda la separazione, non esiste una tecnica cromatografica in grado di separare tutte le specie dell'arsenico.[20] Per questo è prassi comune l'analisi tramite diversi meccanismi cromatografici:[1]
- scambio ionico: è la più diffusa (in particolare quella a scambio anionico), perché sfrutta il fatto che gli arsenozuccheri in soluzione sono generalmente presenti in forma ionica. Come eluenti per lo scambio anionico (AE) vengono usati il diidrogeno fosfato d'ammonio, il carbonato d'ammonio o il bicarbonato d'ammonio, mentre per lo scambio cationico (CE, usato praticamente solo per l'arsenozucchero glicerolo) si usa il formato di piridinio. La temperatura utilizzata è di circa 30-40 °C;
- fase inversa (RP): utilizza colonne C18 ed è particolarmente indicata per i tioarsenozuccheri. Prevede l'utilizzo di agenti di accoppiamento ionico ("ion pairing") per separare specie cariche e neutre nella stessa corsa; quelli tipicamente usati sono gli ioni di tetraalchilammonio a pH neutri o leggermente acidi (per l'accoppiamento anionico) e l'1-butilsolfonato a pH 3 (per l'accoppiamento cationico);
- esclusione dimensionale (SEC): garantisce un'alta tolleranza alla matrice, però non permette un'identificazione univoca degli arsenozuccheri; per questo è utilizzata normalmente come tecnica di purificazione e frazionamento oppure accoppiata con spettrometria di massa tandem;
- multidimensionale: consiste nel far passare il campione attraverso diversi step di separazione, sono state utilizzate SEC-AE-CE, SEC-AE-RP oppure AE-CE.
Un aspetto di cui tener sempre conto per la separazione è che gli arsenozuccheri si presentano spesso come coppie di diastereoisomeri.[14]
Per quanto riguarda la rivelazione, invece, sono usate le seguenti tecniche, quasi sempre accoppiate in linea con un sistema HPLC:[1]
- spettroscopia atomica: sono più sensibili rispetto alle tecniche di spettrometria di massa e dotate di una buona selettività per l'arsenico, ma necessitano di una precedente separazione dei composti perché rivelano l'arsenico totale e non sono in grado di distinguere le diverse specie. La più usata è l'ICP-MS, in grado di garantire ottime prestazioni in termini di sensibilità, intervallo dinamico lineare, robustezza e limiti di rivelabilità; è possibile anche aggiungere un passaggio di generazione di idruri. La sensibilità può essere migliorata ulteriormente con l'aggiunta di piccole quantità di metanolo nella fase mobile,[42] ma in generale concentrazioni medio-alte di solventi organici[43] o di tamponi salini[44] hanno una compatibilità molto limitata con l'ICP-MS. Inoltre, è necessario controllare la presenza di interferenze da cloro (40Ar35Cl+ sul segnale di 75As+).[43] Altre tecniche spettroscopiche usate sono l'ICP-AES,[3] la spettroscopia di fluorescenza atomica[45] e la fluorescenza atomica con generazione di idruri preceduta da foto-ossidazione UV,[45] digestione fotochimica UV[46] o ossidazione termica;[47]
- spettrometria di massa organica: fornisce informazioni strutturali sui composti. Come tecnica di ionizzazione viene normalmente utilizzato l'elettrospray (ESI), ma è stato usato anche il bombardamento con atomi veloci (FAB).[48] Come analizzatore di massa, invece, sono usati il quadrupolo (Q), l'analizzatore a tempo di volo (TOF), la trappola ionica (IT)[49] e l'analizzatore a risonanza ionica ciclotronica a trasformata di Fourier (FT-ICR).[50] Sono molto comuni le configurazioni strumentali in massa tandem, in particolare il triplo quadrupolo, con dissociazione indotta da collisione (CID);
- NMR: è utilizzata solo per applicazioni particolari (ad esempio caratterizzazione o verifica).
Note
[modifica | modifica wikitesto]- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad Niegel, op. cit.
- ^ a b c d e f g h i j Feldmann, op. cit.
- ^ a b (EN) Morita, M., Shibata, Y., Speciation of Arsenic Compounds in Marine Life by High Performance Liquid Chromatography Combined with Inductively Coupled Argon Plasma Atomic Emission Spectrometry, in Analytical Sciences, vol. 3, n. 6, The Japan Society for Analytical Chemistry, 1987, pp. 575-577, DOI:10.2116/analsci.3.575.
- ^ (EN) Shibata, Y., Morita, M., Speciation of Arsenic by Reversed-Phase High Performance Liquid Chromatography-Inductively Coupled Plasma Mass Spectrometry, in Analytical Sciences, vol. 5, n. 1, The Japan Society for Analytical Chemistry, 1989, pp. 107-109, DOI:10.2116/analsci.5.107.
- ^ a b c d Francesconi, op. cit.
- ^ a b c d e f g h i j k (EN) Nischwitz, V., Pergantis, S. A., Liquid Chromatography Online with Selected Reaction Monitoring Electrospray Mass Spectrometry for the Determination of Organoarsenic Species in Crude Extracts of Marine Reference Materials, in Analytical Chemistry, vol. 77, n. 17, American Chemical Society, 2005, pp. 5551-5563, DOI:10.1021/ac050445b.
- ^ a b c d (EN) McSheehy, S., Marcinek, M., Chassaigne, H., Szpunar, J., Identification of dimethylarsinoyl-riboside derivatives in seaweed by pneumatically assisted electrospray tandem mass spectrometry, in Analytica Chimica Acta, vol. 410, n. 1-2, Elsevier, 2000, pp. 71–84, DOI:10.1016/S0003-2670(00)00706-6.
- ^ a b (EN) Edmonds, J. S., Morita, M., Shibata, Y.,, Isolation and identification of arsenic-containing ribofuranosides and inorganic arsenic from japanese edible seaweed Hizikia fusiforme, in Journal of the Chemical Society, Perkin Transactions 1, n. 0, RSC, 1987, pp. 577-580, DOI:10.1039/P19870000577.
- ^ a b c d (EN) McSheehy, S., Szpunar, J., Lobinski, R., Haldys, V., Tortajada, J., Edmonds, J. S., Characterization of Arsenic Species in Kidney of the Clam Tridacna derasa by Multidimensional Liquid Chromatography-ICPMS and Electrospray Time-of-Flight Tandem Mass Spectrometry, in Analytica Chimica Acta, vol. 74, n. 10, RSC, 2002, pp. 2370-2378, DOI:10.1021/ac011136y.
- ^ a b c d e f (EN) Francesconi, K. A., Edmonds, J. S., Stick, R. V., Skelton, B. W., White, A. H., Arsenic-containing ribosides from the brown alga Sargassum lacerifolium: X-ray molecular structure of 2-amino-3-[5'-deoxy-5'-(dimethylarsinoyl)-ribosyloxy]propane-1-sulphonic acid, in Journal of the Chemical Society, Perkin Transactions 1, n. 11, RSC, 1991, pp. 2707-2716, DOI:10.1039/P19910002707.
- ^ a b c d e f (EN) Francesconi, K. A., Edmonds, J. S., Stick, R. V., Arsenic compounds from the kidney of the giant clam Tridacna maxima: isolation and identification of an arsenic-containing nucleoside, in Journal of the Chemical Society, Perkin Transactions 1, n. 11, RSC, 1992, pp. 1349-1357, DOI:10.1039/P19920001349.
- ^ a b c (EN) Nischwitz, V., Pergantis, S. A., Mapping of arsenic species and identification of a novel arsenosugar in giant clams Tridacna maxima and Tridacna derasa using advanced mass spectrometric techniques, in Environmental Chemistry, vol. 4, n. 3, CSIRO, 2007, pp. 187-196, DOI:10.1071/EN07009.
- ^ a b c (EN) Morita, M., Shibata, Y., Isolation and identification of arseno-lipid from a brown alga, Undaria pinnatifida (Wakame), in Chemosphere, vol. 17, n. 6, Elsevier, 1988, pp. 1147–1152, DOI:10.1016/0045-6535(88)90180-4.
- ^ a b c (EN) Edmonds, J. S., Francesconi, K. A., Stick, R. V., Arsenic compounds from marine organisms, in Natural Product Reports, vol. 10, n. 4, RSC, 1993, pp. 421-428, DOI:10.1039/NP9931000421.
- ^ a b (EN) Kahn, M., Raml, R., Schmeisser, E., Vallant, B., Francesconi, K. A., Goessler, W., Two Novel Thio-Arsenosugars in Scallops Identified with HPLC–ICPMS and HPLC–ESMS, in Environmental Chemistry, vol. 2, n. 3, CSIRO, 1993, pp. 171-176, DOI:10.1071/EN05045.
- ^ (EN) Francesconi, K. A., Goessler, W., Panutrakul, S., Irgolic, K. J., A novel arsenic containing riboside (arsenosugar) in three species of gastropod, in Science of the Total Environment, vol. 221, n. 2-3, Elsevier, 1998, pp. 139–148, DOI:10.1016/S0048-9697(98)00272-1.
- ^ (EN) McSheehy, S., Pohl, P., Vélez, D., Szpunar, J., Multidimensional liquid chromatography with parallel ICP MS and electrospray MS/MS detection as a tool for the characterization of arsenic species in algae, in Analytical and Bioanalytical Chemistry, vol. 372, n. 3, Springer, 2002, pp. 457-466, DOI:10.1007/s00216-001-1182-x.
- ^ (EN) Mcadam, D. P., Perera, A. M. A., Stick, R. V., The Synthesis of (R)-2',3'-Dihydroxypropyl 5-Deoxy-5-Dimethylarsinyl-β-D-Riboside, a Naturally Occurring Arsenic-Containing Carbohydrate, in Australian Journal of Chemistry, vol. 40, n. 11, CSIRO, 1987, pp. 1901-1908, DOI:10.1071/CH9871901.
- ^ a b (EN) Gyepes, A., Schäffer, R., Bajor, G., Woller, Á., Fodor, P., Synthesis and chromatographic study of methyl-2,3-O-isopropylidene-5-dimethyl-arsinoyl-β-D-ribofuranoside and methyl-2,3-O-isopropylidene-5-deoxy-5-dimethyl-thioarsinoyl-β-D-ribofuranoside, in Polyhedron, vol. 27, n. 12, Elsevier, 2008, pp. 2655–2661, DOI:10.1016/j.poly.2008.04.049.
- ^ a b c d (EN) McSheehy, S., Pohl, P., Lobinski, R., Szpunar, J., Investigation of arsenic speciation in oyster test reference material by multidimensional HPLC-ICP-MS and electrospray tandem mass spectrometry (ES-MS-MS), in The Analyst, vol. 126, n. 7, RSC, 2001, pp. 1055–1062, DOI:10.1039/b102225n.
- ^ (EN) Edmonds, J. S., Francesconi, K. A., Arseno-sugars from brown kelp (Ecklonia radiata) as intermediates in cycling of arsenic in a marine ecosystem, in Nature, vol. 289, n. 5798, Nature Publishing Group, 1981, pp. 602-604, DOI:10.1038/289602a0.
- ^ (EN) Francesconi, K. A., Edmonds, J. S., Arsenic and marine organisms, in Advances in Inorganic Chemistry, vol. 44, Elsevier, 1996, pp. 147-189, DOI:10.1016/S0898-8838(08)60130-0.
- ^ (EN) Madsen, A. D., Goessler, W., Pedersen, S. N., Francesconi, K. A., Characterization of an algal extract by HPLC-ICP-MS and LC-electrospray MS for use in arsenosugar speciation studies, in Journal of Analytical Atomic Spectrometry, vol. 15, n. 6, RSC, 2000, pp. 657-662, DOI:10.1039/B001418O.
- ^ (EN) Raml, R., Francesconi, K. A., Goessler, W., Improved chromatographic separation of thio-arsenic compounds by reversed-phase high performance liquid chromatography-inductively coupled plasma mass spectrometry, in Journal of Chromatography A, vol. 1128, n. 1-2, Elsevier, 2006, pp. 164–170, DOI:10.1016/j.chroma.2006.06.061.
- ^ (EN) Edmonds, J. S., Francesconi, K. A., Arsenic-containing ribofuranosides: isolation from brown kelp Ecklonia radiata and nuclear magnetic resonance spectra, in Journal of the Chemical Society, Perkin Transactions 1, n. 0, RSC, 1983, pp. 2375-2382, DOI:10.1039/P19830002375.
- ^ a b c d e (EN) Francesconi, K. A., Arsenic species in seafood: Origin and human health implications, in Pure and Applied Chemistry, vol. 82, n. 2, IUPAC, 2010, pp. 373–381, DOI:10.1351/PAC-CON-09-07-01.
- ^ (EN) Geiszinger, A., Goessler, W., Pedersen, S. N., Francesconi, K. A., Arsenic biotransformation by the brown macroalga Fucus serratus, in Environmental Toxicology and Chemistry, vol. 20, n. 10, Wiley, 2001, pp. 2255-2262, DOI:10.1002/etc.5620201018.
- ^ (EN) Cooney, R. V., Mumma, R. O., Benson., A. A., Arsoniumphospholipid in algae, in PNAS, vol. 75, n. 9, United States National Academy of Sciences, 1978, pp. 4262-4264, DOI:10.1073/pnas.75.9.4262.
- ^ (EN) Navratilova, J., Raber, G., Fisher, S. J., Francesconi, K. A., Arsenic cycling in marine systems: degradation of arsenosugars to arsenate in decomposing algae, and preliminary evidence for the formation of recalcitrant arsenic, in Environmental Chemistry, vol. 8, n. 1, CSIRO, 2011, pp. 44–51, DOI:10.1071/EN10107.
- ^ a b c (EN) Andrewes, A., DeMarini, D. M., Funasaka, K., Wallace, K., Lai, V. W. M., Sun, H., Cullen, W. R., Kitchin, K. T., Do Arsenosugars Pose a Risk to Human Health? The Comparative Toxicities of a Trivalent and Pentavalent Arsenosugar, in Environmental Science & Technology, vol. 38, n. 15, American Chemical Society, 2004, pp. 4140–4148, DOI:10.1021/es035440f.
- ^ (EN) Shimbo, S., Hayase, A., Murakami, M., Hatai, I., Higashikawa, K., Moon, C. S., Zhang, Z. W., Watanabe, T., Iguchi, H., Ikeda, M., Use of a food composition database to estimate daily dietary intake of nutrient or trace elements in Japan, with reference to its limitation, in Food Additives and Contaminants, vol. 13, n. 7, Taylor & Francis, 1996, pp. 775-786, DOI:10.1080/02652039609374465.
- ^ WHO, Evaluation of certain food additives and contaminants (Thirty-third report of the Joint FAO/WHO Expert Committee on Food Additives) (PDF), in WHO Technical Report Series, vol. 776, Ginevra, EFSA, 1989.
- ^ Gruppo di esperti scientifici dell'EFSA sui contaminanti nella catena alimentare (CONTAM), Parere scientifico sull'arsenico negli alimenti (PDF), in EFSA Journal, vol. 7, n. 10, EFSA, 1996, p. 1351, DOI:10.2903/j.efsa.2009.1351.
- ^ (EN) Oya-Ohta, Y., Kaise, T., Ochi, T., Induction of chromosomal aberrations in cultured human fibroblasts by inorganic and organic arsenic compounds and the different roles of glutathione in such induction, in Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, vol. 357, n. 1-2, Elsevier, 1996, pp. 123–129, DOI:10.1016/0027-5107(96)00092-9.
- ^ (EN) Sakurai, T., Review: Biological effects of organic arsenic compounds in seafood, in Applied Organometallic Chemistry, vol. 16, n. 8, Wiley, 2002, pp. 401–405, DOI:10.1002/aoc.325.
- ^ a b (EN) van Hulle, M., Zhang, C., Schotte, B., Mees, L., Vanhaecke, F., Vanholder, R., Zhang, X. R., Cornelis, R., Identification of some arsenic species in human urine and blood after ingestion of Chinese seaweed Laminaria, in Journal of Analytical Atomic Spectrometry, vol. 19, n. 1, RSC, 2004, pp. 58-64, DOI:10.1039/B307457A.
- ^ a b (EN) Francesconi, K. A., Tanggaard, R., McKenzie, C. J., Goessler, W., Arsenic Metabolites in Human Urine after Ingestion of an Arsenosugar, in Clinical Chemistry, vol. 48, n. 1, American Association for Clinical Chemistry, 2002, pp. 92–101.
- ^ (EN) Raab, A., Wright, S., Jaspars, M., Meharg, A., Feldmann, J., Pentavalent Arsenic Can Bind to Biomolecules, in Angewandte Chemie International Edition, vol. 46, n. 15, Wiley, 2007, pp. 2594–2597, DOI:10.1002/anie.200604805.
- ^ (EN) Gamble, B. M., Gallagher, P. A., Shoemaker, J. A., Parks, A. N., Freeman, D. M., Schwegel, C. A., Creed, J. T., An investigation of the chemical stability of arsenosugars in basic environments using IC-ICP-MS and IC-ESI-MS/MS, in The Analyst, vol. 128, n. 12, RSC, 2003, pp. 1458–1461, DOI:10.1039/B306931A.
- ^ a b (EN) Gallagher, P. A., Shoemaker, J. A., Wei, S. X., Brockhoff-Schwegel, C. A., Creed, J. T., Extraction and detection of arsenicals in seaweed via accelerated solvent extraction with ion chromatographic separation and ICP-MS detection, in Fresenius' Journal of Analytical Chemistry, vol. 369, n. 1, Springer, 2001, pp. 71-80, DOI:10.1007/s002160000585.
- ^ (EN) Gallagher, P. A., Wei, X., Shoemaker, J. A., Brockhoff, C. A., Creed, J. T., Detection of arsenosugars from kelp extracts via IC-electrospray ionization-MS-MS and IC membrane hydride generation ICP-MS, in Journal of Analytical Atomic Spectrometry, vol. 14, n. 12, RSC, 1999, pp. 1829-1834, DOI:10.1039/A906249A.
- ^ (EN) Allain, P., Jaunault, L., Mauras, Y., Mermet, J.M., Delaporte, T., Signal enhancement due to the presence of carbon-containing compounds in inductively coupled plasma mass-spectrometry, in Analytical Chemistry, vol. 63, n. 14, American Chemical Society, 1991, pp. 1497-1498, DOI:10.1021/ac00014a028.
- ^ a b (EN) McSheehy, S., Szpunar, J., Morabito, R., Quevauviller, P., The speciation of arsenic in biological tissues and the certification of reference materials for quality control, in Trends in Analytical Chemistry, vol. 22, n. 4, Elsevier, 2003, pp. 2370-2378, DOI:10.1016/S0165-9936(03)00404-7.
- ^ (EN) B'Hymer, C., Caruso, J. A., Arsenic and its speciation analysis using high-performance liquid chromatography and inductively coupled plasma mass spectrometry, in Journal of Chromatography A, vol. 1045, n. 1-2, Elsevier, 2004, pp. 1–13, DOI:10.1016/j.chroma.2004.06.016.
- ^ a b (EN) Sánchez-Rodas, D., Geiszinger, A.; Gómez-Ariza, J. L.; Francesconi, K. A., Determination of an arsenosugar in oyster extracts by liquid chromatography-electrospray mass spectrometry and liquid chromatography-ultraviolet photo-oxidation-hydride generation atomic fluorescence spectrometry, in The Analyst, vol. 127, n. 1, RSC, 2002, pp. 60-65, DOI:10.1039/B107527F.
- ^ (EN) Šlejkovec, Z., van Elteren, J. T., Woroniecka, U. D., Underestimation of the total arsenic concentration by hydride generation techniques as a consequence of the incomplete mineralization of arsenobetaine in acid digestion procedures, in Analytica Chimica Acta, vol. 443, n. 2, Elsevier, 2001, pp. 277–282, DOI:10.1016/S0003-2670(01)01223-5.
- ^ (EN) Almela, C., Laparra, J. M., Vélez, D., Barberá, R., Farré, R., Montoro, R., Arsenosugars in Raw and Cooked Edible Seaweed: Characterization and Bioaccessibility, in Journal of Agricultural and Food Chemistry, vol. 53, n. 18, American Chemical Society, 2005, pp. 7344–7351, DOI:10.1021/jf050503u.
- ^ (EN) Pergantis, S. A., Francesconi, K.A., Goessler, W., Thomas-Oates, J. E., Characterization of Arsenosugars of Biological Origin Using Fast Atom Bombardment Tandem Mass Spectrometry, in Analytical Chemistry, vol. 69, n. 23, American Chemical Society, 1997, pp. 4931–4937, DOI:10.1021/ac9704422.
- ^ (EN) Miguens-Rodriguez, M., Pickford, R., Thomas-Oates, J. E., Pergantis, S. A., Arsenosugar identification in seaweed extracts using high-performance liquid chromatography/electrospray ion trap mass spectrometry, in Rapid Communications in Mass Spectrometry, vol. 16, n. 5, Wiley, 2002, pp. 323–331, DOI:10.1002/rcm.578.
- ^ (EN) Pickford, R., Miguens-Rodriguez, M., Afzaal, S., Speir, P., Pergantis, S. A., Thomas-Oates, J. E., Application of the high mass accuracy capabilities of FT-ICR-MS and Q-ToF-MS to the characterisation of arsenic compounds in complex biological matrices, in Journal of Analytical Atomic Spectrometry, vol. 17, n. 3, RSC, 2002, pp. 173-176, DOI:10.1039/B109842J.
Bibliografia
[modifica | modifica wikitesto]- (EN) Feldmann, J., Krupp, E. M., Critical review or scientific opinion paper: Arsenosugars — a class of benign arsenic species or justification for developing partly speciated arsenic fractionation in foodstuffs?, in Analytical and Bioanalytical Chemistry, vol. 399, n. 5, Springer, 2011, pp. 1735–1741, DOI:10.1007/s00216-010-4303-6.
- (EN) Francesconi, K. A., Kuehnelt, D., Determination of arsenic species: A critical review of methods and applications, 2000–2003, in The Analyst, vol. 129, n. 5, RSC, 2004, pp. 373-395, DOI:10.1039/B401321M.
- (EN) Niegel, C., Matysik, F.-M., Analytical methods for the determination of arsenosugars — A review of recent trends and developments, in Analytica Chimica Acta, vol. 657, n. 2, Elsevier, 2010, pp. 83-99, DOI:10.1016/j.aca.2009.10.041.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file sugli arsenozuccheri
Wikimedia Commons contiene immagini o altri file sugli arsenozuccheri
Collegamenti esterni
[modifica | modifica wikitesto]- Arsenosugars sul sito dell'EVISA