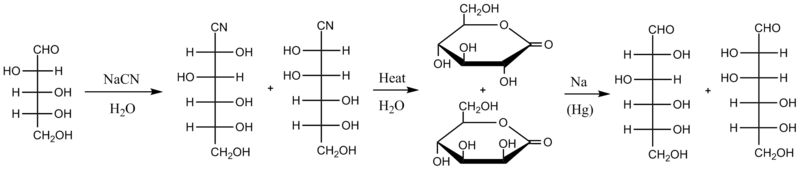
La sintesi di Kiliani-Fischer è un metodo utilizzato per la sintesi dei monosaccaridi. Sfrutta la formazione e la successiva idrolisi di una cianidrina, ottenendo in questo modo l'allungamento della catena di un aldoso tramite l'aggiunta di un atomo di carbonio mantenendo la stereochimica di tutti gli altri atomi di carbonio chirali. Il nuovo atomo di carbonio chirale che viene prodotto origina una miscela di diastereoisomeri chiamati epimeri. Per esempio, il D-arabinosio viene convertito in una miscela di D-glucosio e D-mannosio.
Sintesi di Kiliani-Fischer classica
[modifica | modifica wikitesto]La versione originale della sintesi di Kiliani-Fischer procede attraverso intermedi che implicano la formazione di una cianidrina e di un lattone di un acido aldonico. Il primo passo consiste nel far reagire lo zucchero di partenza con un cianuro acquoso (tipicamente NaCN); il cianuro dà addizione nucleofila al gruppo carbonilico dello zucchero (gli zuccheri esistono principalmente sotto forma di emiacetali ciclici, ma sono sempre in equilibrio con la loro forma aldeidica o chetonica a catena aperta, e nel caso degli aldosi è la forma aldeidica che reagisce in questa sintesi). La cianidrina risultante da questa addizione viene riscaldata in acqua, il che produce l'idrolisi del gruppo nitrilico che diventa un acido carbossilico che reagisce velocemente con una funzione alcolica della stessa molecola formando un lattone più stabile. Il risultato sono due lattoni diastereomeri nella miscela di reazione. Questi vengono separati (attraverso cromatografia, ripartizione in solventi differenti, o un altro metodo di separazione) e successivamente il lattone desiderato viene ridotto con amalgama di sodio. Come illustrato sotto, il D-arabinosio viene convertito in D-glucononitrile e D-mannononitrile, e successivamente viene convertito in D-gluconolattone e D-mannonolattone, separato, e ridotto a D-glucosio o D-mannosio. La resa di questo metodo è circa del 30%.
Versione moderna
[modifica | modifica wikitesto]Più recentemente, è stato sviluppato un metodo di riduzione migliore che produce rese alquanto superiori per gli zuccheri più grandi. Invece della conversione della cianidrina a lattone, la cianidrina viene ridotta in presenza di un catalizzatore a base di palladio e solfato di bario, utilizzando acqua come solvente. La cianidrina viene quindi ridotta a immina che si idrolizza velocemente formando un gruppo aldeidico. Lo zucchero finale è perciò prodotto attraverso due stadi piuttosto che i tre della sintesi classica. Alla fine è possibile isolare direttamente gli zuccheri finali al posto dei lattoni. Il catalizzatore è necessario per evitare l'ulteriore riduzione dell'aldeide a gruppo alcolico, che produrrebbe un alditolo. Le reazioni riportate sotto illustrano questa versione moderna per la conversione di L-treosio a L-xilosio e L-lixosio.

Bibliografia
[modifica | modifica wikitesto]- Carey, Francis A. (2006). Organic Chemistry, Sixth Edition, New York, NY: McGraw-Hill. ISBN 0-07-111562-5
- Rajendra Varmaa, Dexter Frencha: Mechanism of the cyanohydrin (Kiliani-Fischer) synthesis. Carbohydrate Research. 25(1): 71-79 (1972) DOI: 10.1016/S0008-6215(00)82748-2
Voci correlate
[modifica | modifica wikitesto]
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Sintesi di Kiliani-Fischer
Wikimedia Commons contiene immagini o altri file su Sintesi di Kiliani-Fischer