| Ione perossidisolfato | |
|---|---|
 | |
| Nome IUPAC | |
| mu-perossido-bis(triossidosolfato)(2-)[1] | |
| Caratteristiche generali | |
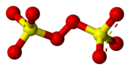
| Formula bruta o molecolare | S2O2−8 |
| Massa molecolare (u) | 192.112 |
| Numero CAS | |
| SMILES | [O-]S(=O)(=O)OOS(=O)(=O)[O-] |
| Indicazioni di sicurezza | |
| Frasi H | --- |
| Consigli P | --- |
Lo ione perossidisolfato, chiamato anche persolfato, è un anione appartenente alla classe dei perossisolfati, di formula S2O2−8. Possiede due atomi di zolfo con stato di ossidazione +6.
I sali contenenti questo ione vengono chiamati perossidisolfati, e si formano quando il suo acido coniugato, l'acido perossidisolforico, reagisce con una base.
Applicazioni
[modifica | modifica wikitesto]Lo ione perossidisolfato viene utilizzato:
- combinato coi metalli alcalini, nell'estrazione della lignina
- combinato con ammonio, potassio o sodio, come iniziatore di polimerizzazione plastica
- nella decolorazione degli olii
- disinfettante per le acque
- come fertilizzante e agente per migliorare la qualità del suolo
- in qualità di forte agente ossidante, nelle reazioni chimiche (Eº = 2,0 V)
Le reazioni di ossidazione a cui prende parte il persolfato sono lente, ma vengono catalizzate da Ag+. Viene utilizzato per preparare permanganato a partire da Mn2+:
- 2Mn2+ + 5S2O2−8 + 8H2O → 2MnO−4 + 10SO2−4 + 16H+
Un anione perossido dello zolfo analogo al perossidisolfato, ma molto più instabile, è il perossimonosolfato.
Note
[modifica | modifica wikitesto]- ^ Nomenclature of Inorganic Chemistry : IUPAC Recommendations 2005 (Red Book), Cambridge, The Royal Society of Chemistry, 2005, p. 315, ISBN 978-0-85404-438-2.
Bibliografia
[modifica | modifica wikitesto]- Ivano Bertini e Fabrizio Mani, Chimica inorganica, CEDAM, ISBN 88-13-16199-9.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Perossidisolfato
Wikimedia Commons contiene immagini o altri file su Perossidisolfato