| Solfato di idrazonio | |
|---|---|
 | |
| Nomi alternativi | |
| Solfato di idrazina, idrazinio solfato | |
| Caratteristiche generali | |
| Formula bruta o molecolare | (N2H6)SO4 |
| Massa molecolare (u) | 130,12 g/mol |
| Aspetto | solido bianco |
| Numero CAS | |
| Numero EINECS | 233-110-4 |
| PubChem | 24842 |
| SMILES | [NH3+]N.OS(=O)(=O)[O-] |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,37 (20 °C) |
| Solubilità in acqua | 30 g/l (20 °C) |
| Temperatura di fusione | 254 °C (527 K) (decomposizione) |
| Temperatura di ebollizione | °C (273 K) (decomposizione) |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
  
| |
| pericolo | |
| Frasi H | 228 - 331 |
| Consigli P | 201 - 273 - 280 - 302+352 - 304+340 - 309+310 [1][2] |
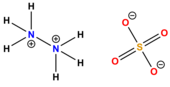
Il solfato di idrazonio (o solfato di idrazina o idrazinio solfato), è il sale dell'idrazina e dell'acido solforico:

L'idrazina, presenta lo stato di ossidazione -2 sull'azoto, e possiede energiche proprietà riducenti: alla temperatura ordinaria precipita allo stato metallico (quindi riduce) gli ioni rame, argento, oro e platino, ed è facilmente ossidata dal permanganato, dagli iodati, dagli ipocloriti e dall'ossigeno atmosferico[4]. L'idrazina però è anche un composto con carattere nettamente basico che, per trattamento con un acido minerale, forma i cosiddetti sali di idrazonio; in particolare, per trattamento con acido solforico, forma il solfato acido di idrazonio, (N2H5)HSO4[3][5], che a temperatura ambiente si presenta come un solido cristallino bianco, inodore, di natura non-combustibile[6] e solubile in acqua[1][2]. È un composto cancerogeno, tossico, allergenico, pericoloso per l'ambiente.
Il solfato d'idrazina, (N2H6)SO4, viene usato come sostanza madre per la standardizzazione di una soluzione di idrossido di sodio[7]:

Fatta cioè una pesata esatta di solfato d'idrazina (noti quindi i suoi grammi esatti), dividendo per il suo peso equivalente (PE), che in questo caso è uguale a 1/2 della sua massa molare (130.12 g/mol)[2], si ricavano gli equivalenti di solfato d'idrazina, che al punto equivalente della titolazione con NaOH (da standardizzare) saranno uguali agli equivalenti di NaOH. Questi equivalenti di NaOH così trovati, divisi per il volume di NaOH consumato al punto finale della titolazione, daranno la concentrazione della soluzione di NaOH che sarà così determinata ed espressa come normalità (N).
Note
[modifica | modifica wikitesto]- ^ a b scheda del solfato di idrazina su IFA-GESTIS Archiviato il 2 aprile 2015 in Internet Archive.
- ^ a b c Scheda del solfato d'idrazonio su PubChem
- ^ a b Formazione del solfato acido d'idrazonio (N2H5)HSO4
- ^ idrazina, in Treccani.it – Enciclopedie on line, Roma, Istituto dell'Enciclopedia Italiana.
- ^ idrazònio, in Sapere.it, De Agostini.
- ^ Il test standard per la determinazione di non-combustibilità di una sostanza è il numero CAN4-S114-M80 (R1997) (Standard Method of Test for Determination of Non-Combustibility in Building Materials) – vedere anche pagina 223 del testo Flammability Testing of Materials Used in Construction, Transport and Mining
- ^ a b Small-Scale Synthesis of Laboratory Reagents with Reaction Modeling di Leonid Lerner (pagina 110)
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su solfato di idrazonio
Wikimedia Commons contiene immagini o altri file su solfato di idrazonio








