| Folding@home software | |
|---|---|
 | |
| Genere | Calcolo distribuito |
| Sviluppatore | Pande laboratory, Sony, Nvidia, ATI, Cauldron Development LLC |
| Data prima versione | 1º ottobre 2000 |
| Ultima versione | 7.5.1 (1º giugno 2018) |
| Sistema operativo | Microsoft Windows macOS Linux |
| Licenza | In parte GPL, in parte proprietario[1] (licenza non libera) |
| Sito web | foldingathome.org/ |
Folding@home (talvolta abbreviato come FAH o F@h) è un progetto che utilizza il calcolo distribuito per simulare e studiare diversi fenomeni, quali il ripiegamento delle proteine, la progettazione di farmaci e altri tipi di dinamiche molecolari. Il progetto usa la potenza di calcolo inutilizzata di migliaia di PC di proprietà di volontari, che hanno deciso di installare e di eseguire un apposito software sul proprio computer. Il suo scopo principale è quello di determinare i meccanismi di ripiegamento delle proteine, che è il processo mediante il quale le proteine raggiungono la loro struttura tridimensionale finale, e di esaminare le cause che portano ad errati ripiegamenti delle stesse.
Quest'ultimo fenomeno è di notevole interesse nella ricerca medica, in quanto ha implicazioni dirette su molte patologie quali la malattia di Alzheimer, la malattia di Huntington e molte forme di cancro, oltre ad altre malattie. In misura minore Folding@home cerca anche di prevedere la struttura finale di una proteina e di determinare come altre molecole vadano ad interagire con essa, un'attività molto utile per la ricerca farmacologica. Folding@home è sviluppato e gestito dal laboratorio Pande alla Stanford University, sotto la direzione del professor Vijay Pande, ed è condiviso da varie istituzioni scientifiche e laboratori di ricerca in tutto il mondo.[2]
Il progetto è stato pioniere nell'uso nel calcolo distribuito di schede video e console da gioco, più precisamente la PlayStation 3. La metodologia di simulazione impiegata, basata sulla statistica, rappresenta un cambiamento di paradigma rispetto ai tradizionali approcci computazionali.[3] Il software in esecuzione sui computer dei volontari si collega ad un server del progetto, riceve un piccolo frammento (work unit) di una simulazione completa, effettua su tale frammento i calcoli richiesti e restituisce il risultato al server, dove le work unit vengono assemblate nella simulazione completa.
I volontari possono tenere traccia dei loro contributi sul sito web Folding@home sotto forma di un punteggio basato sul lavoro totale svolto, il che rende la partecipazione dei volontari competitiva ed incoraggia il coinvolgimento a lungo termine.
Folding@home è uno dei sistemi di calcolo più veloci del mondo, con una velocità di oltre 100 petaFLOPS,[4] ovvero più potente di tutti i progetti in esecuzione sulla piattaforma di calcolo distribuito BOINC messi insieme (soprattutto grazie all'utilizzo di gpu). Il progetto è stato anche il simulatore di dinamica molecolare più potente del mondo fino alla metà del 2011. Queste caratteristiche hanno consentito di effettuare simulazioni molto più complesse e lunghe di quanto precedentemente realizzato con strutture informatiche tradizionali. Dal suo lancio il 1º ottobre 2000, il laboratorio di Pande ha prodotto 109 articoli di ricerca scientifica basati sull'attività di Folding@home.[5] Le prove sperimentali in seguito realizzate concordano con i risultati delle simulazioni.[6][7][8]
Significato del progetto
[modifica | modifica wikitesto]
Le proteine sono una componente essenziale per molte funzioni biologiche, e prendono parte a quasi tutti i processi metabolici all'interno delle cellule. Spesso agiscono come enzimi, eseguendo reazioni biochimiche tra cui la segnalazione cellulare, il trasporto molecolare e la regolazione cellulare. Possono servire come elementi strutturali costituendo una sorta di scheletro per cellule. Altre proteine partecipano al sistema immunitario, agendo da anticorpi. Prima che una proteina possa assumere questi ruoli, la lunga catena di amminoacidi di cui è composta deve ripiegarsi in una struttura tridimensionale adeguata allo scopo, un processo che spesso avviene spontaneamente e dipende dalle interazioni all'interno della sequenza aminoacidica con l'ambiente circostante. Pertanto, la comprensione del ripiegamento delle proteine è fondamentale per capire appieno il funzionamento di una proteina, ed è considerato un "Santo Graal" della biologia computazionale.[9][10]
Nonostante il ripiegamento si verifichi all'interno di un ambiente cellulare affollato, in genere procede senza intoppi. Tuttavia, a causa delle proprietà chimiche di una proteina o di altri fattori, possono verificarsi ripiegamenti non corretti: le proteine possono, cioè, seguire un percorso di ripiegamento alternativo e finire deformi. A meno che i meccanismi cellulari siano in grado di distruggere o di rieseguire il ripiegamento di tali proteine, esse possono successivamente aggregarsi e causare una serie di malattie debilitanti.[11] Gli esperimenti di laboratorio che studiano questi processi sono di limitato aiuto per la comprensione delle meccaniche del fenomeno. Di conseguenza gli scienziati utilizzano modelli numerici basati sulla fisica che, integrando gli esperimenti, cercano di fornire un quadro più completo sulle meccaniche del ripiegamento e dell'aggregazione delle proteine.[12][13]
A causa della complessità delle proteine lo spazio delle configurazioni, ovvero l'insieme delle possibili forme che una proteina può assumere, è enormemente vasto. Senza un’adeguata potenza di calcolo le simulazioni di dinamica molecolare a livello atomico sono state a lungo limitate dal punto di vista del tempo totale analizzato: mentre la maggior parte delle proteine si ripiegano in genere nell'ordine di millisecondi[12][14], prima del 2010 le simulazioni potevano raggiungere solo tempi dell'ordine dei nanosecondi e del microsecondo.[6] In diverse analisi sono stati utilizzati Supercomputer, ma tali sistemi sono intrinsecamente costosi e tipicamente condivisi tra molti gruppi di ricerca. Inoltre, poiché le dinamiche analizzate sono difficilmente parallelizzabili, la scalabilità delle simulazioni molecolari tradizionali su queste architetture risulta essere difficile.[15][16] Un'ulteriore difficoltà all'analisi numerica è costituito dal fatto che il ripiegamento delle proteine è un processo stocastico, ovvero poco stabile nel tempo, è computazionalmente difficile utilizzare lunghe simulazioni per una visione globale del processo di ripiegamento.[17][18]

Il folding delle proteine non avviene in un unico passaggio.[11] Al contrario, le proteine passano la maggior parte del loro tempo, fino a quasi il 96% in alcuni casi[19], "in attesa" in vari stati conformazionali intermedi, ognuno con una propria energia termodinamica libera minima rispetto all'energia complessiva della proteina. Attraverso un processo noto come campionamento adattivo, queste conformazioni sono utilizzati da Folding@home come punti di partenza per un insieme di traiettorie da simulare. Poiché le simulazioni scoprono più conformazioni, le traiettorie vengono riavviate da esse, e un modello di stato Markov (MSM) è progressivamente creato da questo processo ciclico. Gli MSM sono modelli di equazioni di massima discreti che descrivono la conformazione e l'energia di una biomolecola come un insieme di strutture distinte e delle brevi transizioni tra di loro.[non chiaro] L'approccio del modello di stato di Markov al campionamento adattivo aumenta significativamente l'efficienza della simulazione, in quanto evita il calcolo dell'energia interna locale minima, e favorisce il calcolo (anche con GPUGrid) in quanto consente l'aggregazione, in senso statistico, di brevi traiettorie simulate indipendentemente.[20] La quantità di tempo necessaria per costruire un modello di Markov è inversamente proporzionale al numero di simulazioni parallele da eseguire, cioè in prima analisi dal numero di processori disponibili. In altre parole, si ottiene una parallelizzazione lineare, portando a una riduzione di circa quattro ordini di grandezza del tempo di calcolo complessivo rispetto ad un tradizionale approccio di calcolo serializzato. Un MSM completo può contenere decine di migliaia di stati di esempio dallo spazio di fase della proteina, ovvero come detto di tutte le conformazioni che la proteina può assumere, e le transizioni tra tali stati. Il modello illustra gli eventi di folding e i relativi percorsi, e i ricercatori possono poi utilizzare il clustering cinetico per visualizzare una rappresentazione grossolana del modello altrimenti altamente dettagliato[non chiaro]. Essi possono utilizzare questi MSM per capire come le proteine sbaglino a ripiegarsi, e verificare sperimentalmente le previsioni ottenute tramite tali simulazioni.[3][17][21]
Tra il 2000 e il 2010, la lunghezza delle proteine che Folding@home ha studiato è aumentata di quattro volte, mentre i tempi simulati del folding delle proteine sono aumentati di sei ordini di grandezza.[22] Nel 2002 Folding@home ha usato modelli di stato di Markov per un tempo totale di conto di circa un milione di giorni di simulazioni su CPU nell'arco di qualche mese,[8] e nel 2011, MSM ha parallelizzato un'altra simulazione che ha richiesto complessivamente 10 milioni di ore di calcolo con CPU.[23] Nel gennaio 2010, Folding@home ha utilizzato un MSM per simulare la dinamica del lento ripiegamento a 32 residui della proteina NTL9 per 1,52 millisecondi, un lasso di tempo in linea con le previsioni sperimentali ma mille volte più lungo di quanto precedentemente calcolabile. Il modello consisteva in molte traiettorie individuali, e ha fornito un livello di dettaglio senza precedenti nel panorama energetico della proteina.[3][6]
Riconoscimenti
[modifica | modifica wikitesto]Nel 2010 il ricercatore Gregory Bowman della Folding@home è stato insignito del Thomas Kuhn Paradigma Award dalla American Chemical Society per lo sviluppo del software open-source MSMBuilder e per il raggiungimento di accordo quantitativo tra teoria e la sperimentazione.[24][25]
Per il suo lavoro, Pande è stato insignito del 2012 Michael and Kate Bárány Award for Young Investigators per "lo sviluppo di metodi di calcolo per la definizione della dimensione e dei cambiamenti per la produzione di importanti modelli teorici per il folding delle proteine e dell'RNA"[26], così come il 2006 Irving Sigal Young Investigator Award per i suoi risultati di simulazione che "hanno stimolato un riesame del significato di entrambi i metodi di misurazione a insieme e a singola molecola, facendo sì che gli sforzi del Dr. Pande siano pionieri dei contributi alla metodologia di simulazione."[27]
La ricerca biomedica
[modifica | modifica wikitesto]L'errato folding delle proteine può provocare una varietà di malattie come la malattia di Alzheimer, cancro, malattia di Creutzfeldt-Jakob, la fibrosi cistica, la malattia di Huntington, l'anemia falciforme, e il diabete di tipo II.[11][28][29] L'infezione cellulare da parte di virus come l'HIV e l'influenza coinvolgono anche il folding sulle membrane cellulari.[30] Quando le proteine deformi saranno capite meglio, potranno essere sviluppate terapie che aumentano la capacità naturale delle cellule di regolare il ripiegamento delle proteine. Tali terapie includono l'uso di molecole ingegnerizzate per alterare la produzione di una certa proteina, per aiutare a distruggere una proteina deforme, o per aiutare nel processo di folding.[31] La combinazione del modellamento molecolare computazionale e dell'analisi sperimentale dà la possibilità di fondamentalmente plasmare il futuro della medicina molecolare e della pianificazione razionale delle terapie,[13] ad esempio accelerando e riducendo i costi della scoperta di farmaci.[32] L'obiettivo dei primi cinque anni di Folding@home è stato quello di fare progressi nella comprensione del folding, mentre l'obiettivo attuale è quello di capire l'errato folding e le malattie connesse, in particolare la malattia di Alzheimer.[33]
Le simulazioni eseguite su Folding@home sono utilizzate in combinazione con esperimenti di laboratorio,[17] ma i ricercatori possono usare esse per studiare come il folding in vitro differisce dal folding nell'ambiente cellulare nativo. Ciò è vantaggioso per studiare alcuni aspetti del corretto ed errato folding, e loro relazione con la malattie che sono difficili da osservare sperimentalmente. Ad esempio, nel 2011 Folding@home ha simulato il folding di una proteina all'interno di un tunnel di uscita ribosomiale, per aiutare gli scienziati a capire meglio come il naturale confinamento e l'affollamento potrebbero influenzare il processo di folding.[34][35] Inoltre, gli scienziati di solito impiegano denaturanti chimici per dispiegare le proteine dal loro stato nativo stabile. Non è generalmente noto come il denaturante influisce nel ripiegamento della proteina, ed è difficile da determinare sperimentalmente se questi stati denaturati contengano strutture residue che possano influenzare il comportamento del folding. Nel 2010 Folding@home ha utilizzato le GPU per simulare gli stati liberi della proteina L, e ha previsto il suo tasso di caduta in forte accordo con i risultati sperimentali.[36]
Il laboratorio Pande è parte della Stanford University, un ente senza scopo di lucro, e non vende i risultati generati da Folding@home.[37] I grandi insiemi di dati del progetto sono disponibili gratuitamente per altri ricercatori utilizzabili previa richiesta e alcuni sono accessibili dal sito web Folding@home.[38][39] Il laboratorio Pande ha collaborato con altri sistemi di dinamica molecolare, come il supercomputer Blue Gene,[40] e loro condividono parti chiave del software di Folding@home con altri ricercatori, in modo che gli algoritmi di cui ha beneficiato Folding@home possano aiutare altre aree scientifiche.[38] Nel 2011 hanno pubblicato il software open-source Copernico, che si basa sul MSM di Folding@home e altre tecniche di parallelizzazione e mira a migliorare l'efficienza e la scalabilità di simulazioni molecolari su grandi cluster di computer o supercomputers.[41][42] Sintesi di tutte le scoperte scientifiche di Folding@home sono scritte sul sito web Folding@home dopo la pubblicazione.[5]
Malattia di Alzheimer
[modifica | modifica wikitesto]
La malattia di Alzheimer è una malattia neurodegenerativa incurabile che principalmente colpisce gli anziani e rappresenta più della metà di tutti i casi di demenza. La sua causa esatta rimane sconosciuta, ma la malattia è identificata come una malattia dovuta all'errato folding. L'Alzheimer è associato con aggregazioni tossiche della betamiloide (Aβ) peptide, causate dall'errato folding di un Aβ e l'aggregazione con altri peptidi Aβ. Questi aggregati di Aβ poi crescono in modo significativo fino a diventare placche senili, un marker patologico della malattia di Alzheimer.[43][44][45] A causa della natura eterogenea di tali aggregati, tecniche sperimentali come la cristallografia a raggi X e l'NMR hanno avuto difficoltà nel caratterizzare le loro strutture. Inoltre, le simulazioni atomiche di aggregazione Aβ sono estremamente impegnative a causa della loro dimensione e complessità.[46][47]
Prevenire l'aggregazione Aβ è un promettente approccio per lo sviluppo di farmaci terapeutici per la malattia di Alzheimer, secondo i Dot. Naeem e Fazili in un articolo di revisione della letteratura.[48] Nel 2008 Folding@home ha simulato le dinamiche di aggregazione Aβ con dettaglio atomico su scale temporali dell'ordine di decine di secondi. Gli studi precedenti sono stati solo in grado di simulare circa 10 microsecondi - Folding@home è stato in grado di simulare il folding di Aβ per sei ordini di grandezza più a lungo rispetto al passato. I ricercatori hanno utilizzato i risultati di questo studio per individuare una forcina beta che è stata una delle principali fonti di interazioni molecolari all'interno della struttura.[49] Lo studio ha contribuito a preparare il laboratorio Pande per i futuri studi di aggregazione e di ulteriori ricerche per trovare un piccolo peptide che potrebbe stabilizzare il processo di aggregazione.[46]
Nel dicembre 2008, Folding@home ha trovato diversi candidati che sembrano inibire la tossicità degli aggregati Aβ.[50] Nel 2010, in stretta collaborazione con il Center for Protein Folding Machinery, questi candidati hanno cominciato ad essere testati su tessuto biologico.[29] Nel 2011 Folding@home ha completato simulazioni di diverse mutazioni di Aβ che sembrano stabilizzare la formazione di aggregati, il che potrebbe aiutare nello sviluppo di approcci terapeutici del farmaco per la malattia e di grande aiuto ai studi sperimentali con la spettroscopia NMR dei oligomeri di Aβ.[47][51] Nello stesso anno, Folding@home ha iniziato simulazioni di vari frammenti di Ap per determinare in che modo i vari enzimi naturali influenzano la struttura e la piegatura di Aβ.[52][53]
Malattia di Huntington
[modifica | modifica wikitesto]La malattia di Huntington è una malattia genetica neurodegenerativa che è associata con l'errato folding e l'aggregazione delle proteine. Ripetizioni eccessive del amminoacido glutammina nel NTD della proteina Huntingtina provocano aggregazione, e anche se il comportamento delle ripetizioni non è completamente compreso, esse provocano il declino cognitivo associato alla malattia.[54] Come con altri aggregati, vi è difficoltà nel determinare sperimentalmente la sua struttura.[55] Gli scienziati stanno usando Folding@home per studiare la struttura della proteina Huntingtina e prevedere come si forma, assistendo con l'approccio alla progettazione razionale di farmaci per fermare la formazione di aggregati.[29] Il frammento N17 della Huntingtina accelera questa aggregazione, e mentre ci sono stati diversi meccanismi proposti, il suo esatto ruolo in questo processo rimane in gran parte sconosciuto.[56] Folding@home ha simulato questo e altri frammenti per chiarire il loro ruolo nella malattia.[57] Dal 2008, gli approcci alla progettazione dei farmaci per la malattia di Alzheimer sono stati applicati per la malattia di Huntington.[29]
Cancro
[modifica | modifica wikitesto]Più della metà di tutti i tumori noti coinvolgono mutazioni di p53, una proteina soppressore tumorale presente in ogni cellula che regola il ciclo cellulare e segna la morte cellulare in caso di danneggiamento del DNA. Specifiche mutazioni in p53 possono disturbare queste funzioni, consentendo a una cellula anormale di continuare a crescere incontrollata, con conseguente sviluppo di tumori. L'analisi di queste mutazioni aiuta a spiegare le cause di tumori p53-correlati.[58] Nel 2004 Folding@home è stato utilizzato per eseguire il primo studio di dinamica molecolare del ripiegamento delle proteine dimero di p53 in una simulazione atomica nell'acqua. I risultati della simulazione hanno concordato con le osservazioni sperimentali e hanno dato informazioni sul folding del dimer che prima non erano ottenibili.[59] Questa è stata la prima pubblicazione a revisione paritaria sul cancro da parte di un progetto di calcolo distribuito.[60] L'anno successivo, Folding@home ha alimentato un nuovo metodo per identificare gli amminoacidi essenziali per la stabilità di una proteina, che è stata poi utilizzata per studiare le mutazioni di p53. Il metodo era abbastanza preciso nell'identificare mutazioni promotrici del cancro e ha determinato gli effetti di specifiche mutazioni che non sarebbero potute altrimenti essere misurate sperimentalmente.[61]
Folding@home è utilizzato anche per studiare chaperone proteici[29] e proteine da shock termico che svolgono ruoli essenziali nella sopravvivenza cellulare assistendo al folding delle altre proteine nell'ambiente affollato e chimicamente stressante all'interno di una cellula. Cellule tumorali in rapida crescita si affidano a chaperon specifici, e alcuni chaperon svolgono un ruolo chiave nella resistenza alla chemioterapia. L'inibizione di questi specifici chaperon è vista come un potenziale meccanismo d'azione per efficaci farmaci chemioterapici o per ridurre la diffusione del cancro.[62] Utilizzando Folding@home e lavorando a stretto contatto con il Center for Protein Folding Machinery, il Pande lab spera di trovare un farmaco che inibisce gli chaperon coinvolti in cellule cancerose.[63] I ricercatori stanno anche utilizzando Folding@home per studiare altre molecole legate al cancro, come ad esempio l'enzima Src kinase e di alcune forme della homeodomain engrailed - una proteina di grandi dimensioni che potrebbe essere coinvolta in molte malattie, compreso il cancro.[64][65] Nel 2011 Folding@home ha iniziato simulazioni di dinamica del piccola proteina knottin EETI, che può identificare carcinomi nella diagnostica per immagini legandosi ai recettori di superficie delle cellule tumorali.[66][67]
L'Interleuchina 2 (IL-2) è una proteina che aiuta le cellule T del sistema immunitario ad attaccare patogeni e tumori. Sfortunatamente, il suo uso come trattamento del cancro è limitato a causa di gravi effetti collaterali come l'edema polmonare. IL-2 si lega a queste cellule polmonari in modo diverso rispetto alle cellule T, quindi la ricerca sull'IL-2 implica la comprensione delle differenze tra questi meccanismi vincolanti. Nel 2012 Folding@home ha contribuito con la scoperta di una forma di IL-2 trecento volte più efficace nella sua azione all'interno del sistema immunitario. Negli esperimenti, questa forma alterata ha significativamente sovraperformato l'IL-2 naturale a ostacolare la crescita del tumore. L'industria farmaceutica ha espresso interesse nella molecola mutante, e il National Institutes of Health la sta testando contro una grande varietà di modelli tumorali, nella speranza di accelerare il suo sviluppo come terapia.[68][69]
Osteogenesi imperfetta
[modifica | modifica wikitesto]L'osteogenesi imperfetta, nota come malattia delle ossa fragili, è una malattia genetica incurabile delle ossa che può essere letale. Quelli con la malattia non sono in grado di creare tessuto osseo connettivo funzionale. Questo è più comunemente causato da una mutazione al collagene di tipo I,[70] che soddisfa una varietà di ruoli strutturali ed è la proteina più abbondante nei mammiferi.[71] La mutazione causa una deformazione nella struttura a tripla elica del collagine, che se non naturalmente distrutta, conduce a un tessuto osseo anormale e indebolito.[72] Nel 2005 Folding@home ha testato una nuova tecnica di meccanica quantistica che migliora i metodi di simulazione precedenti, e che può essere utile per i futuri studi computazionali sul collagene.[73] Anche se i ricercatori hanno usato Folding@home per studiare il folding della collagine, l'interesse si pone come un progetto pilota rispetto alla ricerca sulla malattia di Alzheimer e di Huntington.[29]
Virus
[modifica | modifica wikitesto]Folding@home sta aiutando nella ricerca verso la prevenzione di certi virus come l'influenza e l'HIV dal riconoscere ed entrare nelle cellule biologiche.[29] Nel 2011 Folding@home ha iniziato delle simulazioni della dinamica del enzima RNasi H, una componente chiave del virus HIV, nella speranza di progettare farmaci per disattivarlo.[74] Folding@home è stato utilizzato anche per studiare la fusione della membrana, un evento fondamentale per l'infezione virale e una vasta gamma di funzioni biologiche. Questa fusione comporta cambiamenti conformazionali delle proteine di fusione virali e del docking proteinico,[30] ma i meccanismi molecolari esatti dietro la fusione rimangono in gran parte sconosciuti.[75] Le fusioni possono consistere di oltre mezzo milione di atomi che interagiscono per centinaia di microsecondi. Questa complessità limita le simulazioni informatiche tipiche a circa 10.000 atomi che interagiscono per decine di nanosecondi: una differenza di diversi ordini di grandezza.[49] Lo sviluppo di modelli per prevedere i meccanismi di fusione della membrana aiuterà nella comprensione scientifica di come bloccare il processo con farmaci antivirali.[76] Nel 2006 gli scienziati hanno applicato modelli di stato di Markov e Folding@home per scoprire due percorsi per la fusione e di ottenere altre informazioni sui meccanismi.[49]
A seguito di simulazioni dettagliate di Folding@home di piccole cellule conosciute come vescicole, nel 2007, il laboratorio di Pande ha introdotto una nuova tecnica di calcolo per la misurazione della topologia dei suoi cambiamenti strutturali durante la fusione.[77] Nel 2009 i ricercatori hanno utilizzato Folding@home per studiare mutazioni dell'influenza emoagglutinina, una proteina che si attacca un virus alla sua cellula ospite e assiste all'ingresso del virus. Le mutazioni di emoagglutinina influenzano quanto bene la proteina si lega ai recettori di superficie delle cellule di un ospite, che determina quanto infettivo il ceppo del virus sia per l'organismo ospitante. Conoscere gli effetti delle mutazioni dell'emoagglutinina aiuta nello sviluppo di farmaci antivirali.[78][79] A partire dal 2012, Folding@home continua a simulare il folding e le interazioni dell'emoagglutinina, integrando studi sperimentali presso l'Università della Virginia.[29][80]
Progettazione di farmaci
[modifica | modifica wikitesto]I farmaci funzionano legandosi a posizioni specifiche su molecole bersaglio e provocando un certo cambiamento desiderato, ad esempio disabilitando il bersaglio o inducendo un cambiamento conformazionale. Idealmente, un farmaco deve agire in modo molto specifico e legarsi solo con il suo bersaglio senza interferire con altre funzioni biologiche. Tuttavia, è difficile determinare con precisione dove e quanto bene due molecole si legano. A causa di limiti nella potenza di calcolo, attualmente gli approcci in silico di solito devono sacrificare velocità per precisione, ad esempio, utilizzare metodi di docking proteinico rapidi invece di calcoli dell'energia libera computazionalmente costosi. Le prestazioni computazionali di Folding@home permettono ai ricercatori di utilizzare entrambe le tecniche, e valutare la loro efficienza e affidabilità.[33][81][82] La progettazione di farmaci computazionale ha il potenziale di accelerare e ridurre i costi di scoperta delle medicine.[32] Nel 2010 Folding@home ha usato dei MSM e dei calcoli di energia libera per predire lo stato nativo della villina all'interno di 1,8 Å RMSD (scarto quadratico medio) dalla struttura cristallina determinata sperimentalmente attraverso la cristallografia a raggi X. Questa precisione ha implicazioni per gli approcci alle future previsioni di strutture proteiche, compresi le proteine intrinsecamente non strutturate.[49] Gli scienziati hanno usato Folding@home per sulla ricerca farmacoresistenza, studiando la vancomicina, un antibiotico di "ultima istanza", e beta-lattamasi, una proteina in grado di abbattere gli antibiotici come la penicillina.[83][84]
Attività chimica si verifica lungo il sito attivo di una proteina. Approcci tradizionali alla progettazione dei farmaci implicano un legame ermetico con questo sito, bloccando la sua attività, assumendo che la proteina bersaglio esiste in un'unica struttura rigida. Tuttavia, questo approccio funziona solo per circa il 15% di tutte le proteine. Le proteine contengono siti allosterici che, quando collegati da piccole molecole, possono alterare la conformazione di una proteina e infine influenzare l'attività della proteina. Questi siti sono bersagli farmacologici interessanti, ma la loro individuazione ha un alto costo computazionale. Nel 2012 Folding@home e MSM sono stati utilizzati per identificare un sito allosterico in tre proteine clinicamente rilevanti: beta-lattamasi, interleuchina-2, e RNasi H.[84][85]
Circa la metà di tutti gli antibiotici conosciuti interferiscono con il funzionamento del ribosoma di un batterio, una grande e complessa macchina biochimica che esegue la biosintesi delle proteine, traducendo l'RNA messaggero in proteine. Gli antibiotici macrolidi intasano il tunnel di uscita del ribosoma, impedendo la sintesi delle proteine batteriche essenziali. Nel 2007 il Pande laboratorio ha ricevuto una borsa di studio per lo studio e la progettazione di nuovi antibiotici.[29] Nel 2008 hanno usato Folding@home per studiare l'interno di questo tunnel e come specifiche molecole possono influenzare esso.[86] La struttura completa del ribosoma è stata solo di recente stabilita, e Folding@home ha simulato anche proteine ribosomali, dato che molte delle loro funzioni rimangono in gran parte sconosciute.[87]
Partecipazione
[modifica | modifica wikitesto]
Oltre a riferire i processori attivi, Folding@home determina la sua potenza di calcolo, misurata in operazioni in virgola mobile al secondo (FLOPS) sulla base del tempo di esecuzione effettivo dei suoi calcoli. Originariamente questo è stato segnalato come FLOPS nativi: le prestazioni nette di ogni tipo di hardware di elaborazione.[88] Nel marzo 2009 Folding@home ha iniziato a comunicare la performance in nativo e x86 FLOPS,[89] essendo quest'ultimo una stima di quanti FLOPS il calcolo dovrebbe tenere su un'architettura CPU x86 standard, che è comunemente usata come riferimento di prestazioni. Hardware specializzato come le GPU possono efficacemente svolgere determinate funzioni complesse in operazioni a singola virgola mobile che altrimenti richiederebbero più operazioni su architettura x86. La misura x86 tenta di appianare queste differenze hardware.[88] Nonostante conversioni conservative, i x86 FLOPS dei client GPU sono costantemente superiori ai FLOPS nativi e comprendono una grande maggioranza delle prestazioni di calcolo misurate su Folding@home.[90][91]
Nel 2007 il Guinness ha riconosciuto Folding@home come la più potente rete di calcolo distribuito.[92] Al 6 giugno 2013, il progetto ha 499.600 core attivi e 24.375 GPU attive per un totale di 14.561 petaFLOPS x86 (7.572 petaFLOPS nativi).[90] Allo stesso tempo, gli sforzi combinati di tutti i progetti di calcolo distribuito sotto BOINC ammonta a 7.380 petaFLOPS.[93] Nel novembre 2012 Folding@home ha aggiornato il suo metodo di conteggio dei FLOPS, specialmente per le GPU, e ora riporta il numero di core del processore attivi nonché i processori fisici.[94] Utilizzando l'approccio del modello di stato Markov, Folding@home raggiunge un forte scaling su tutta la sua base di utenti e guadagna un aumento di velocità lineare per ogni processore aggiuntivo.[3][17] Questa rete consente a Folding@home di fare il lavoro che in precedenza era computazionalmente impraticabile.[40]
Nel marzo 2002 il cofondatore di Google Sergey Brin ha lanciato Google Compute come un add-on per la Google Toolbar.[95] Anche se limitata in termini di funzionalità e di portata, è aumentata la partecipazione a Folding@home da 10.000 a circa 30.000 CPU attive.[96] Il programma si è concluso nel mese di ottobre 2005 a favore dei client ufficiali di Folding@home, e non è più disponibile per la barra degli strumenti.[97] Folding@home ha anche guadagnato partecipanti da Genome@Home, un progetto di calcolo distribuito dal laboratorio Pande e un progetto sorella di Folding@home. L'obiettivo di Genome@Home era la progettazione di proteine e le applicazioni associate. Dopo la sua conclusione ufficiale nel marzo 2004, gli utenti sono stati invitati a donare la potenza di calcolo di Folding@home.[98]
Performance
[modifica | modifica wikitesto]
Il 16 settembre 2007, dovuto in gran parte alla partecipazione di PS3, il progetto Folding@home ha ufficialmente raggiunto un livello di prestazioni sostenute superiore a un petaFLOPS nativo, diventando il primo sistema di calcolo di qualsiasi tipo a farlo.[99][100] Il supercomputer più veloce della TOP500 all'epoca era BlueGene/L, a 0.280 petaFLOPS.[101] L'anno seguente, il 7 maggio 2008, il progetto ha raggiunto un livello di prestazioni sostenute superiore a due petaFLOPS nativi,[102] seguito dalle pietre miliari di tre e quattro petaFLOPS native rispettivamente il 20 agosto[103][104] e il 28 settembre 2008.[105] Il 18 febbraio 2009, Folding@home ha raggiunto cinque petaFLOPS nativi,[106][107] ed è stato il primo progetto di calcolo ad arrivare a questo livello.[108][109] In confronto, il supercomputer più veloce del novembre 2008 era Roadrunner di IBM a 1.105 petaFLOPS.[110] Il 10 novembre 2011, le prestazioni di Folding@home hanno superato i sei petaFLOPS nativi con equivalenti di quasi otto petaFLOPS x86.[100][111]
Punti
[modifica | modifica wikitesto]Analogamente ad altri progetti di calcolo distribuito, Folding@home valuta quantitativamente i contributi degli utenti per il progetto attraverso un sistema di crediti.[112] Tutte le unità di un dato progetto hanno un credito di base uniforme, che è determinato sulla base di benchmark di una o più work units di quel progetto su una macchina di riferimento ufficiale prima che il progetto venga avviato.[112] Ogni utente riceve questi punti base per il completamento di ogni work unit, attraverso l'utilizzo di una chiave di accesso si possono ricevere punti bonus aggiuntivi per l'affidabilità e la rapidità nel completamento di unità che sono computazionalmente più esigenti o hanno una maggiore priorità scientifica.[113][114] Gli utenti possono anche ricevere crediti per il loro lavoro da parte di client su più macchine.[37] Questo sistema di punti tenta di allineare i crediti ottenuti con il valore dei risultati scientifici.[112]
Gli utenti possono registrare i loro contributi in una squadra, che combina i punti di tutti i membri. Un utente può avviare la propria squadra, oppure può far parte di un team già esistente.[115] In alcuni casi, una squadra può avere le proprie fonti di reclutamento, come un forum su Internet.[116] I punti possono favorire la competizione amichevole tra individui e gruppi per calcolare il massimo per il progetto, il che può beneficiare la comunità del folding e accelerare la ricerca scientifica.[112][117][118] Statistiche individuali e di squadra sono pubblicati sul sito Folding@home.[112]
Software
[modifica | modifica wikitesto]Il software di Folding@home dell'utente finale comprende tre componenti principali: work unit, cores, e un client.
Work unit
[modifica | modifica wikitesto]Una work unit (unità di lavoro) sono i dati delle proteine che il client è chiamato a elaborare. Le unità di lavoro sono una frazione della simulazione tra gli stati in un modello di stato di Markov. Dopo che l'unità è stata scaricata e completamente elaborata dal computer di un volontario, viene restituita al server di Folding@home, che poi assegnerà al volontario i punti. Questo ciclo si ripete automaticamente.[117] Tutte le unità di lavoro hanno scadenze associate, e se questo termine viene superato, l'utente non può ottenere crediti e l'unità sarà inviata automaticamente a un altro volontario. Dato che il folding delle proteine è di serie in natura e molte unità di lavoro sono generate dai loro predecessori, questo permette al processo di simulazione complessiva di procedere normalmente se un'unità di lavoro non viene restituita dopo un periodo di tempo ragionevole. A causa di queste scadenze, il requisito minimo di sistema per Folding@home è una CPU Pentium 3 a 450 MHz con Streaming SIMD Extensions (SSE).[37] Tuttavia, le work unit per i client ad alto rendimento hanno una scadenza molto più breve rispetto a quelli per il client monoprocessore, dato che una parte importante del beneficio scientifico dipende dal completare rapidamente simulazioni.[119]
Prima della release pubblica, le work unit passano attraverso diverse fasi di controllo qualità per contenere le problematiche prima di diventare pienamente disponibile. Queste fasi di test includono uno stato di intern, beta, e advanced, prima di una versione finale completa su Folding@home.[120] Le work unit di Folding@home sono normalmente trattate solo una volta, tranne nel raro caso in cui si verifichino errori durante l'elaborazione. Se ciò si verifica per tre utenti diversi, l'unità viene ritirata automaticamente dalla distribuzione.[121][122] Il forum di supporto di Folding@home può essere utilizzato per distinguere tra i problemi derivanti dall'hardware e cattive work unit.[123]
Core
[modifica | modifica wikitesto]Programmi specializzati nella dinamica molecolare, denominati FahCores e spesso abbreviati "core", eseguono i calcoli sulla work unit come un processo in background. La grande maggioranza dei core di Folding@home si basano su GROMACS,[117] uno dei più veloci e più popolari pacchetti software di dinamica molecolare, che è in gran parte costituito da codice assembly ottimizzato manualmente e di ottimizzazioni hardware.[124][125] Sebbene GROMACS sia un software open-source e ci sia uno sforzo di cooperazione tra il laboratorio Pande e gli sviluppatori di GROMACS, Folding@home utilizza una licenza closed-source per garantire la validità dei dati.[126] Core meno attivi includono ProtoMol e SHARPEN. Folding@home ha utilizzato AMBRA, CPMD, Desmond, e Tinker, ma questi sono ormai in pensione e non sono più in servizio attivo.[127][128] Alcuni di questi core eseguono calcoli espliciti di solvatazione in cui il solvente circostante (generalmente acqua) è modellato atomo per atomo; mentre altri eseguono metodi impliciti di solvatazione, in cui il solvente è trattato come un continuum matematico.[129][130] Il core è separato dal client per aggiornare i metodi scientifici automaticamente senza richiedere un aggiornamento client. I core creano periodicamente punti di controllo di calcolo in modo che, se vengono interrotti, possano riprendere il lavoro da questo punto e non dall'inizio.[117]
Client
[modifica | modifica wikitesto]I partecipanti a Folding@home installano un programma client sul proprio personal computer o la console di gioco PS3. L'utente interagisce con il client, che gestisce gli altri componenti software in background. Attraverso il client, l'utente può mettere in pausa il processo di folding, aprire il registro eventi, controllare l'avanzamento dei lavori o visualizzare le statistiche personali.[131] I client vengono continuamente eseguiti in background con una priorità molto bassa, usando la potenza di calcolo inutilizzata così che il normale utilizzo del computer è inalterato.[37][115] Il massimo utilizzo della CPU può essere regolato tramite le impostazioni del client.[131][132] Il client si connette a un server di Folding@home e recupera una work unit e può anche scaricare il core appropriato per le impostazioni del client, il sistema operativo e la sottostante architettura hardware. Dopo l'elaborazione la work unit viene restituita ai server di Folding@home. I client sono fatti su misura per sistemi monoprocessore e multiprocessore, così come per le GPU. Mentre questi ultimi client utilizzano molte più risorse, la diversità e la potenza di ogni architettura hardware fornisce a Folding@home la possibilità di completare in modo efficiente molti tipi di simulazioni in modo tempestivo (in poche settimane o mesi invece che anni), che è di rilevante valore scientifico. Insieme, questi client permettono ai ricercatori di studiare questioni biomediche precedentemente considerate impraticabili da affrontare computazionalmente.[33][117][119]
Gli sviluppatori di software professionali sono responsabili della maggior parte del codice di Folding@home, sia per il lato client che server. Il team di sviluppo comprende programmatori di Nvidia, ATI, Sony e Cauldron Development.[133] I client possono essere scaricati solo da sito ufficiale di Folding@home o dei suoi partner commerciali, e potranno interagire solo con files di Folding@home. Essi potranno caricare e scaricare dati dal server Stanford di Folding@home (sulla porta 8080, con 80 come alternativa), e la comunicazione viene verificata utilizzando la firma digitale a 2048 bit.[37][134] Mentre la GUI del client è open-source,[135] il client stesso è proprietario per motivi di integrità scientifica e di sicurezza.[136][137][138]
Folding@home sfrutta le librerie software Cosm per il networking.[117][133] Folding@home è stato lanciato il 1º ottobre 2000 ed è stato il primo progetto di calcolo distribuito volto a sistemi biomolecolari.[139] Il suo primo client era uno screensaver, che sarebbe stato eseguito mentre il computer non è era altrimenti in uso.[140][141] Nel 2004 il laboratorio di Pande ha collaborato con David Anderson per testare un client supplementare sul framework open-source BOINC. Questo client è stato distribuito in closed beta nell'aprile 2005,[142] tuttavia, l'approccio è diventato impraticabile ed è stato accantonato nel giugno 2006.[143]
GPU
[modifica | modifica wikitesto]L'hardware specializzato delle GPU è stato progettato per accelerare il rendering di applicazioni grafiche 3D, come i videogiochi ed è in grado di sovraperformare in modo significativo le CPU per alcuni tipi di calcoli. Le GPU sono una delle piattaforme di calcolo più potenti e in più rapida crescita, e molti scienziati e ricercatori stanno perseguendo un computing di uso generale sulle unità di elaborazione grafica (GPGPU). Tuttavia, l'hardware della GPU è difficile da usare per compiti non grafici e di solito richiede una significativa ristrutturazione dell'algoritmo e una conoscenza avanzata della architettura sottostante.[144] Tale personalizzazione è impegnativa, soprattutto per i ricercatori con limitate risorse di sviluppo software. Folding@home sfrutta la libreria open source OpenMM, che utilizza un modello di progettazione ponte con due livelli di interfacce di programmazione delle applicazioni (API) per interfacciare il software di simulazione molecolare all'architettura hardware sottostante. Con l'aggiunta di ottimizzazioni hardware, le simulazioni GPU basate su OpenMM non richiedono modifiche significative ma ottengono prestazioni quasi uguali al codice manualmente ottimizzato per la GPU, e superano notevolmente le implementazioni della CPU.[129][145]
Prima del 2010 l'affidabilità computazionale dell'hardware consumer GPGPU era in gran parte sconosciuta, e le prove indiziarie legate alla mancanza di un rilevatore e correttore di errori integrato nella memoria della GPU sollevarono problemi di affidabilità. Nel primo test su larga scala dell'accuratezza scientifica delle GPU, uno studio del 2010 su oltre 20.000 host della rete domestica Folding@home rilevarono errori software nei sottosistemi di memoria di due terzi della GPU testate. Questi errori fortemente correlati all'architettura della board, anche se lo studio ha concluso che l'affidabilità del GPU Computing era comunque fattibile purché venisse rivolta particolare attenzione alle caratteristiche hardware, come il rilevamento degli errori sul lato software.[146]
La prima generazione di client GPU di Folding@home (GPU1) è stata distribuita al pubblico il 2 ottobre 2006,[143] offrendo un aumento di velocità 20-30X per certi calcoli rispetto alle sue controparti CPU basate su GROMACS.[147] Era la prima volta che le GPU erano state utilizzate sia per il calcolo distribuito che per grandi calcoli di dinamica molecolare.[148][149] GPU1 ha dato ai ricercatori una significativa conoscenza ed esperienza con lo sviluppo di software GPGPU, ma in risposta alle inesattezze scientifiche con DirectX, il 10 aprile 2008 è stato superato da GPU2, la seconda generazione del client.[147] Dopo l'introduzione di GPU2, GPU1 è stata ufficialmente ritirata il 6 giugno.[147] Rispetto al GPU1, GPU2 era più scientificamente affidabile e produttiva, eseguibile su ATI e GPU CUDA NVIDIA, e supportava algoritmi più avanzati, proteine più grandi, e la visualizzazione in tempo reale della simulazione.[150][151] A seguito di questo, la terza generazione del client GPU di Folding@home (GPU3) è stata distribuita il 25 maggio 2010. Mentre era retrocompatibile con GPU2, GPU3 era più stabile, efficiente e ha avuto una maggiore flessibilità nelle sue capacità scientifiche[152] e ha usato OpenMM su di un framework OpenCL.[152] I client GPU non supportano nativamente il sistema operativo OS-X e Linux, anche se gli utenti Linux con schede grafiche Nvidia possono eseguirlo attraverso l'applicazione software Wine.[153][154] Le GPU rimangono la piattaforma di Folding@home più potente in termini di FLOPS, da novembre 2012 i client GPU contribuiscono all'87% al throughput in x86 petaFLOPS dell'intero progetto.[90]
PlayStation 3
[modifica | modifica wikitesto]Da marzo 2007 fino al novembre 2012, Folding@home ha usufruito della potenza di calcolo delle PlayStation 3. Al momento della sua nascita, il suo processore Cell di streaming ha consegnato un aumento di velocità di 20 volte rispetto a un PC in certi calcoli, potenza di elaborazione che non può essere trovata su altri sistemi come la Xbox 360.[33][96] L'alta velocità ed efficienza delle PS3 introdusse altre opportunità di ottimizzazioni valevoli secondo la legge di Amdahl, e ha significativamente cambiato il trade-off tra efficienza computazionale e la precisione complessiva, consentendo l'utilizzo di modelli molecolari più complessi a poco costo computazionale aggiuntivo.[155] Questo ha permesso a Folding@home di eseguire calcoli biomedici che sarebbero stati altrimenti incalcolabili.[156]
Il client PS3 è stato sviluppato in uno sforzo di collaborazione tra Sony e il Pande lab ed è uscito come un client stand-alone il 23 marzo 2007.[33][157] La sua uscita ha fatto diventare Folding@home il primo progetto di calcolo distribuito ad usare PS3.[158] Il 18 settembre dell'anno successivo, il client PS3 è diventato un canale di Life with PlayStation al suo lancio.[159][160] In termini di tipi di calcoli che si possono eseguire, al momento della sua introduzione il client era un compromesso tra la flessibilità di una CPU e la velocità di una GPU.[117] Tuttavia, a differenza di CPU e GPU, gli utenti non erano in grado di eseguire altre attività sulla loro PS3 durante l'esecuzione di Folding@home.[156] L'ambiente uniforme della console rese più facile il supporto e rese Folding@home più user friendly.[33] La PS3 ha anche la capacità di trasmettere dati rapidamente alla sua GPU, il che è stato utilizzato per la visualizzazione in tempo reale a livello atomico delle dinamiche proteiche attuali.[155]
Il 6 novembre 2012, Sony ha concluso il supporto per il client di Folding@home PS3 e gli altri servizi disponibili nell'ambito Life with PlayStation. Durante la sua durata di cinque anni e 7 mesi, più di 15 milioni di utenti hanno contribuito a oltre 100 milioni di ore di calcolo a Folding@home, aiutando notevolmente il progetto di ricerca sulle malattie. A seguito di discussioni con il laboratorio di Pande, Sony ha deciso di terminare l'applicazione. Pande considera il client di PlayStation 3 un "punto di svolta" per il progetto.[91][161][162]
Client di elaborazione multi-core
[modifica | modifica wikitesto]Folding@home può utilizzare le funzionalità di elaborazione parallela dei moderni processori multi-core. La possibilità di utilizzare diversi core della CPU permette il completamento di tutta la simulazione di ripiegamento proteico molto più velocemente. Lavorando insieme, i core della CPU completano un'unica work unit in proporzione più velocemente del client monoprocessore standard. Questo approccio è scientificamente utile perché permette la simulazione di traiettorie molto più lunghe per essere eseguite nella stessa quantità di tempo, e riduce le tradizionali difficoltà di scalare una grande simulazione a molti processori separati.[163] Una pubblicazione del 2007 sul Journal of Molecular Biology ha usato l'elaborazione multi-core per simulare il folding di parte della villina circa 10 volte più a lungo di quanto fosse possibile con un client a singolo processore, in accordo con i tassi di folding sperimentali.[164]
Nel novembre 2006, la prima generazione del client di multiprocessing simmetrico (SMP) è stata distribuita pubblicamente in versione beta per testarla, denominata SMP1.[143] Questi client ha utilizzato il protocollo di comunicazione Message Passing Interface (MPI) per l'elaborazione parallela, dato che in quel momento i core GROMACS non erano stati progettati per essere utilizzati con più thread.[119] Questa era la prima volta che un progetto di calcolo distribuito aveva usato MPI.[165] Anche se i client ottennero buoni risultati nei sistemi operativi basati su Unix come Linux e Mac OS X, erano problematici sotto Windows.[163][165] Il 24 gennaio 2010 SMP2, la seconda generazione dei clienti SMP e il successore di SMP1, è uscito come open beta e ha sostituito il complesso MPI con una più affidabile implementazione basata sui thread.[114][133]
SMP2 supporta una particolare categoria di work unit chiamata "bigadv", progettate per simulare le proteine che sono insolitamente grandi e computazionalmente intensive e hanno una grande priorità scientifica. Queste unità originariamente richiedevano un minimo di otto core per CPU,[166] che è stato successivamente aumentato il 7 febbraio 2012 a sedici core per CPU.[167] Oltre a questi requisiti hardware aggiuntivi rispetto alle work unit standard di SMP2, richiedono più risorse di sistema come memoria RAM e larghezza di banda Internet. In cambio, gli utenti che eseguono queste work unit vengono premiati con un aumento del 20% rispetto al sistema di punti bonus di SMP2.[168] La categoria bigadv permette a Folding@Home di eseguire simulazioni particolarmente impegnative su scale temporali lunghe che in precedenza richiedevano l'utilizzo di cluster di supercomputer e non potevano essere eseguiti in qualsiasi altro luogo su Folding@home.[166]
V7
[modifica | modifica wikitesto]
Il client V7 è la settima e ultima generazione del software client di Folding@home, ed è una completa riscrittura ed unificazione dei client precedenti per Microsoft Windows, macOS e sistemi operativi Linux.[169][170] Come i suoi predecessori, V7 può girare Folding@home in background ad una priorità molto bassa, che consente ad altre applicazioni di utilizzare le risorse della CPU di cui hanno bisogno. È stato progettato per rendere l'installazione, l'avviamento, il funzionamento e più user-friendly per i principianti, così come offrire una maggiore flessibilità scientifica per i ricercatori rispetto ai client precedenti.[171] V7 utilizza Trac per gestire il tracking dei bug in modo che gli utenti possano vedere il suo processo di sviluppo e fornire un feedback.[170] È stato distribuito ufficialmente il 22 marzo 2012.[172]
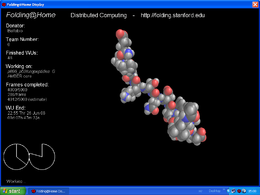
V7 consiste di quattro elementi integrati. L'utente interagisce normalmente con la GUI open-source di V7, nota come FAHControl.[135][173] Questa è dotata di modalità di interfaccia utente per novizi, avanzati ed esperti, e ha la capacità di monitorare, configurare e controllare molti client di folding remoti da un unico computer. FAHControl dirige FAHClien t- un'applicazione di back-end, che a sua volta gestisce ogni FAHSlot (o "slot"). Ogni slot funge da sostituto per i precedentemente distinti Folding@home v6 monoprocessore, SMP e GPU clients per computer, dato che può scaricare, processare, e di caricare work unit in modo indipendente. La funzione FAHViewer, sul modello della PS3, visualizza un rendering 3D in tempo reale, se disponibile, della proteina in corso di elaborazione.[169][170]
Confronto con altri simulatori molecolari
[modifica | modifica wikitesto]Rosetta@home è un progetto di calcolo distribuito con l'obiettivo di predire la struttura delle proteine ed è uno dei più accurati predittori di struttura terziaria.[174][175] Gli stati conformazionali dal software di Rosetta possono essere utilizzati per inizializzare un modello di stato di Markov come punti di partenza di simulazioni per Folding@home.[20] Al contrario, gli algoritmi di predizione di struttura possono essere migliorati dai modelli termodinamici e cinetici e gli aspetti campionati delle simulazioni di folding proteinico.[176] Dato che Rosetta cerca solo di predire lo stato di fold finale, e non come le proteine si piegano, Rosetta@home e Folding@home sono complementari e rispondono a domande molecolari molto diverse.[20][177]
Anton è un supercomputer per uso speciale costruito per simulazioni di dinamica molecolare. Nell'ottobre 2011 Anton e Folding@home sono stati i due più potenti sistemi di dinamica molecolare.[178] Anton è unico nella sua capacità di produrre traiettorie molecolari singole ultra-lunghe e computazionalmente costose,[179] come nel 2010, che ha raggiunto i millisecondi.[180][181] Queste lunghe traiettorie possono essere particolarmente utili verso certi tipi di problemi biochimici.[182][183] Tuttavia, Anton non utilizza modelli di stato di Markov per l'analisi. Nel 2011 il laboratorio Pande ha costruito un MSM da due simulazioni di 100-ms di Anton e ha trovato percorsi di folding alternativi che non erano visibili attraverso la tradizionale analisi di Anton. Hanno concluso che vi erano piccole differenze tra le simulazioni costruite usando da un numero limitato di lunghe traiettorie o uno assemblato da molte traiettorie più brevi.[179] Nel giugno 2011 Folding@home ha iniziato un ulteriore campionamento di una simulazione di Anton nel tentativo di determinare meglio come le sue tecniche si comparano con i metodi di Anton.[184][185] Tuttavia, a differenza delle traiettorie più brevi di Folding@home, che sono più riducibili al calcolo distribuito e di altre tecniche di parallelizzazione, traiettorie più lunghe non richiedono il campionamento adattivo per campionare sufficientemente spazio delle fasi di una proteina. A causa di questo, è possibile che una combinazione dei metodi di simulazione di Anton e di Folding@home fornisca un campionamento più approfondito di questo spazio.[179]
Note
[modifica | modifica wikitesto]- ^ Pande lab, Folding@home Open Source FAQ, su folding.stanford.edu, Stanford University, 2 agosto 2012 (archiviato dall'url originale il 21 settembre 2012).
- ^ Pande lab (2 agosto 2012). "About Folding@home" Archiviato il 16 ottobre 2012 in Internet Archive.. Folding@home. Stanford University. URL consultato il 21 settembre 2012. Richiamato 8 luglio 2013.
- ^ a b c d Vijay S. Pande, Kyle Beauchamp e Gregory R. Bowman, Everything you wanted to know about Markov State Models but were afraid to ask, in Methods, vol. 52, n. 1, 2010, pp. 99-105, DOI:10.1016/j.ymeth.2010.06.002, PMC 2933958, PMID 20570730.
- ^ (EN) Project Timeline – Folding@home, su foldingathome.org. URL consultato il 21 agosto 2018.
- ^ a b Pande lab (27 luglio 2012). "Recent Results and Research Papers from Folding@home". Folding@home. Stanford University. URL archiviato il 21 settembre 2012. Richiamato 8 luglio 2013.
- ^ a b c Vincent A. Voelz, Gregory R. Bowman, Kyle Beauchamp e Vijay S. Pande, Molecular Simulation of ab Initio Protein Folding for a Millisecond Folder NTL9(1−39), in Journal of the American Chemical Society, vol. 132, n. 5, 10 febbraio 2010, pp. 1526-1528, DOI:10.1021/ja9090353, ISSN 0002-7863, PMC 2835335, PMID 20070076.
- ^ G. R. Bowman e V. S. Pande, Protein folded states are kinetic hubs, in Proceedings of the National Academy of Sciences, vol. 107, n. 24, 15 giugno 2010, pp. 10890-10895, DOI:10.1073/pnas.1003962107, ISSN 0027-8424, PMC 2890711, PMID 20534497.
- ^ a b Christopher D. Snow, Houbi Nguyen, Vijay S. Pande e Martin Gruebele, Absolute comparison of simulated and experimental protein-folding dynamics, in Nature, vol. 420, n. 6911, --, pp. 102-106, DOI:10.1038/nature01160, ISSN 0028-0836, PMID 12422224.
- ^ Fabrizio Marinelli, Fabio Pietrucci, Alessandro Laio e Stefano Piana, A Kinetic Model of Trp-Cage Folding from Multiple Biased Molecular Dynamics Simulations, in PLoS Computational Biology, vol. 5, n. 8, 7 agosto 2009, pp. e1000452, DOI:10.1371/journal.pcbi.1000452, ISSN 1553-7358, PMC 2711228, PMID 19662155.
- ^ So Much More to Know, in Science, vol. 309, n. 5731, 1º luglio 2005, pp. 78b–102b, DOI:10.1126/science.309.5731.78b, ISSN 0036-8075, PMID 15994524.
- ^ a b c Heath Ecroyd e John A. Carver, Unraveling the mysteries of protein folding and misfolding, in Iubmb Life, vol. 60, n. 12, 2008, pp. 769-774, DOI:10.1002/iub.117, PMID 18767168.
- ^ a b Protein folding: Then and now, in Archives of Biochemistry and Biophysics, vol. 469, n. 1, 2008, pp. 4-19, DOI:10.1016/j.abb.2007.05.014, PMC 2173875, PMID 17585870.
- ^ a b Leila M Luheshi, Damian Crowther, Christopher Dobson (2008). "Protein misfolding and disease: from the test tube to the organism". Current Opinion in Chemical Biology 12 (1): 25–31. doi:10.1016/j.cbpa.2008.02.011
- ^ Christopher D. Snow, Eric J. Sorin, Young Min Rhee e Vijay S. Pande, How Well Can Simulation Predict Protein Folding Kinetics and Thermodynamics?, in Annual Review of Biophysics and Biomolecular Structure, vol. 34, 2005, pp. 43-69, DOI:10.1146/annurev.biophys.34.040204.144447, PMID 15869383.
- ^ A. Verma, S.M. Gopal, A. Schug, J.S. Oh, K.V. Klenin, K.H. Lee, and W. Wenzel (2008). "Massively Parallel All Atom Protein Folding in a Single Day". Advances in Parallel Computing 15. pp. 527–534, ISBN 978-1-58603-796-3. ISSN 0927-5452.
- ^ Vijay S. Pande, Ian Baker, Jarrod Chapman, Sidney P. Elmer, Siraj Khaliq, Stefan M. Larson, Young Min Rhee, Michael R. Shirts, Christopher D. Snow, Eric J. Sorin e Bojan Zagrovic, Atomistic protein folding simulations on the submillisecond time scale using worldwide distributed computing, in Biopolymers, vol. 68, n. 1, 2003, pp. 91-109, DOI:10.1002/bip.10219, PMID 12579582.
- ^ a b c d Gregory R. Bowman, Vincent A. Voelz e Vijay S. Pande, Taming the complexity of protein folding, in Current Opinion in Structural Biology, vol. 21, n. 1, 2011, pp. 4-11, DOI:10.1016/j.sbi.2010.10.006, PMC 3042729, PMID 21081274.
- ^ John D. Chodera, William C. Swope, Jed W. Pitera e Ken A. Dill, Long‐Time Protein Folding Dynamics from Short‐Time Molecular Dynamics Simulations, in Multiscale Modeling & Simulation, vol. 5, n. 4, 2006, pp. 1214-1226, DOI:10.1137/06065146X.
- ^ Robert B. Best, Atomistic molecular simulations of protein folding, in Current Opinion in Structural Biology, vol. 22, n. 1, 2012, pp. 52-61, DOI:10.1016/j.sbi.2011.12.001, PMID 22257762.
- ^ a b c TJ Lane, Gregory Bowman, Robert McGibbon, Christian Schwantes, Vijay Pande, and Bruce Borden (10 settembre 2012). "Folding@home Simulation FAQ" Archiviato il 13 settembre 2012 in Internet Archive.. Folding@home. Stanford University. Archiviato dall'originale il 21 settembre 2012. Richiamato 8 luglio 2013.
- ^ Gregory R. Bowman, Daniel L. Ensign e Vijay S. Pande, Enhanced Modeling via Network Theory: Adaptive Sampling of Markov State Models, in Journal of Chemical Theory and Computation, vol. 6, n. 3, 2010, pp. 787-794, DOI:10.1021/ct900620b, PMC 3637129, PMID 23626502.
- ^ Vijay Pande (June 8, 2012). "FAHcon 2012: Thinking about how far FAH has come". Folding@home. typepad.com. dall'originale il 21 settembre 2012. Richiamato 8 luglio 2013.
- ^ K. A. Beauchamp, D. L. Ensign, R. Das e V. S. Pande, Quantitative comparison of villin headpiece subdomain simulations and triplet-triplet energy transfer experiments, in Proceedings of the National Academy of Sciences, vol. 108, n. 31, 2011, pp. 12734-12739, DOI:10.1073/pnas.1010880108, PMC 3150881, PMID 21768345.
- ^ "Greg Bowman awarded the 2010 Kuhn Paradigm Shift Award". simtk.org. SimTK: MSMBuilder. 29 marzo 2010. dall'originale il 20 settembre 2012. Richiamato 20 settembre, 2012.
- ^ "MSMBuilder Source Code Repository". MSMBuilder. simtk.org. 2012. dall'originale il 12 ottobre 2012. URL consultato il 12 maggio 2012.
- ^ "Biophysical Society Names Five 2012 Award Recipients". Biophysics.org. Biophysical Society. 17 agosto 2011. dall'originale il 20 settembre 2012. Richiamato 20 settembre, 2012.
- ^ "Folding@home – Awards" Archiviato il 12 luglio 2012 in Internet Archive. (FAQ). Folding@home. Stanford University. agosto 2011. Archiviato dall'originale il 21 settembre 2012. Richiamato 8 luglio 2013.
- ^ Vittorio Bellotti and Monica Stoppini (2009). "Protein Misfolding Diseases" Archiviato il 22 febbraio 2014 in Internet Archive.. The Open Biology Journal 2: 228–234.
- ^ a b c d e f g h i Pande lab (30 maggio 2012). "Folding@home Diseases Studied FAQ" Archiviato il 25 agosto 2012 in Internet Archive. (FAQ). Folding@home. Stanford University. Archiviato dall'originale il 21 settembre 2012. Richiamato 8 luglio 2013.
- ^ a b Collier, Leslie; Balows, Albert; Sussman, Max (1998). Mahy, Brian; Collier, Leslie, eds. Topley and Wilson's Microbiology and Microbial Infections. 1, Virology (nona ed.). London: Arnold. pp. 75–91, ISBN 978-0-340-66316-5.
- ^ Fred E. Cohen e Jeffery W. Kelly, Therapeutic approaches to protein-misfolding diseases, in Nature, vol. 426, n. 6968, 2003, pp. 905-909, DOI:10.1038/nature02265, PMID 14685252.
- ^ a b C. M. Song, S. J. Lim e J. C. Tong, Recent advances in computer-aided drug design, in Briefings in Bioinformatics, vol. 10, n. 5, 2009, pp. 579-591, DOI:10.1093/bib/bbp023, PMID 19433475.
- ^ a b c d e f Pande lab (2012). "Folding@home Press FAQ" Archiviato il 25 agosto 2012 in Internet Archive. (FAQ). Folding@home. Stanford University. Archiviato dall'originale il 21 settembre 2012. Richiamato 8 luglio 2013.
- ^ Christian "schwancr" Schwantes (membro del Pande lab) (15 agosto 2011). "Projects 7808 and 7809 to full fah". Folding@home. phpBB Group. dall'originale il 20 settembre 2012. Richiamato 16 ottobre, 2011.
- ^ D. Lucent, V. Vishal e V. S. Pande, Protein folding under confinement: A role for solvent, in Proceedings of the National Academy of Sciences, vol. 104, n. 25, 2007, pp. 10430-10434, DOI:10.1073/pnas.0608256104, PMC 1965530, PMID 17563390.
- ^ Vincent A. Voelz, Vijay R. Singh, William J. Wedemeyer, Lisa J. Lapidus e Vijay S. Pande, Unfolded-State Dynamics and Structure of Protein L Characterized by Simulation and Experiment, in Journal of the American Chemical Society, vol. 132, n. 13, 2010, pp. 4702-4709, DOI:10.1021/ja908369h, PMC 2853762, PMID 20218718.
- ^ a b c d e Pande lab (18 agosto 2011). "Folding@home Main FAQ" (FAQ). Folding@home. Stanford University. Archiviato dall'originale il 20 settembre 2012. Richiamato 8 luglio 2013.
- ^ a b Vijay Pande (23 aprile 2008). "Folding@home and Simbios". Folding@home. typepad.com. dall'originale il 20 settembre 2012. Estratto 9 novembre 2011.
- ^ Vijay Pande (25 ottobre 2011). "Re: Suggested Changes to F@h Website". Folding@home. phpBB Group. dall'originale il 20 settembre 2012. Estratto 25 ottobre 2011.
- ^ a b Caroline Hadley, Biologists think bigger, in EMBO Reports, vol. 5, n. 3, 2004, pp. 236-238, DOI:10.1038/sj.embor.7400108, PMC 1299019, PMID 14993921.
- ^ S. Pronk, P. Larsson, I. Pouya, G.R. Bowman, I.S. Haque, K. Beauchamp, B. Hess, V.S. Pande, P.M. Kasson, E. Lindahl (2011). "Copernicus: A new paradigm for parallel adaptive molecular dynamics". 2011 International Conference for High Performance Computing, Networking, Storage and Analysis: 1–10, 12–18.
- ^ Sander Pronk, Iman Pouya, Per Larsson, Peter Kasson, and Erik Lindahl (17 novembre 2011). "Copernicus Download". copernicus-computing.org. Copernicus. dall'originale il 12 ottobre 2012. Estratto 2 ottobre 2012.
- ^ G. Brent Irvine, Omar M. El-Agnaf, Ganesh M. Shankar e Dominic M. Walsh, Protein Aggregation in the Brain: The Molecular Basis for Alzheimer's and Parkinson's Diseases, in Molecular Medicine, vol. 14, 7–8, 2008, pp. 451-464, DOI:10.2119/2007-00100.Irvine, PMC 2274891, PMID 18368143.
- ^ Claudio Soto e Lisbell D. Estrada, Protein Misfolding and Neurodegeneration, in Archives of Neurology, vol. 65, n. 2, 2008, pp. 184-9, DOI:10.1001/archneurol.2007.56, PMID 18268186.
- ^ Robin Roychaudhuri, Mingfeng Yang, Minako M. Hoshi e David B. Teplow, Amyloid β-Protein Assembly and Alzheimer Disease, in Journal of Biological Chemistry, vol. 284, n. 8, 2009, pp. 4749-4753, DOI:10.1074/jbc.R800036200, PMC 3837440, PMID 18845536.
- ^ a b Nicholas W. Kelley, V. Vishal, Grant A. Krafft e Vijay S. Pande, Simulating oligomerization at experimental concentrations and long timescales: A Markov state model approach, in The Journal of Chemical Physics, vol. 129, n. 21, 2008, p. 214707, DOI:10.1063/1.3010881, PMC 2674793, PMID 19063575.
- ^ a b Jayakumar Rajadas, Corey W. Liu, Paul Novick, Nicholas W. Kelley, Mohammed Inayathullah, Melburne C. Lemieux e Vijay S. Pande, Rationally Designed Turn Promoting Mutation in the Amyloid-β Peptide Sequence Stabilizes Oligomers in Solution, in PLOS ONE, vol. 6, n. 7, 2011, pp. e21776, DOI:10.1371/journal.pone.0021776, PMC 3142112, PMID 21799748.
- ^ Aabgeena Naeem e Naveed Ahmad Fazili, Defective Protein Folding and Aggregation as the Basis of Neurodegenerative Diseases: The Darker Aspect of Proteins, in Cell Biochemistry and Biophysics, vol. 61, n. 2, 2011, pp. 237-250, DOI:10.1007/s12013-011-9200-x, PMID 21573992.
- ^ a b c d Gregory R. Bowman, Xuhui Huang e Vijay S. Pande, Network models for molecular kinetics and their initial applications to human health, in Cell Research, vol. 20, n. 6, 2010, pp. 622-630, DOI:10.1038/cr.2010.57, PMC 4441225, PMID 20421891.
- ^ Vijay Pande (18 dicembre 2008). "New FAH results on possible new Alzheimer's drug presented". Folding@home. typepad.com. dall'originale il 20 settembre 2012. Estratto 23 settembre 2011.
- ^ Paul A. Novick, Dahabada H. Lopes, Kim M. Branson, Alexandra Esteras-Chopo, Isabella A. Graef, Gal Bitan e Vijay S. Pande, Design of β-Amyloid Aggregation Inhibitors from a Predicted Structural Motif, in Journal of Medicinal Chemistry, vol. 55, n. 7, 2012, pp. 3002-3010, DOI:10.1021/jm201332p, PMC 3766731, PMID 22420626.
- ^ yslin (membro del Pande lab) (22 luglio 2011). "New project p6871 [Classic]". Folding@home. phpBB Group. dall'originale il 20 settembre 2012. Estratto 17 marzo 2012.(richiesta registrazione)
- ^ Pande lab. "Project 6871 Description" Archiviato il 6 gennaio 2016 in Internet Archive.. Folding@home. Stanford University. dall'originale il 20 settembre 2012. Estratto 27 settembre 2011.
- ^ Francis O. Walker, Huntington's disease, in The Lancet, vol. 369, n. 9557, 2007, pp. 218-228, DOI:10.1016/S0140-6736(07)60111-1, PMID 17240289.
- ^ Nicholas W. Kelley, Xuhui Huang, Stephen Tam, Christoph Spiess, Judith Frydman e Vijay S. Pande, The Predicted Structure of the Headpiece of the Huntingtin Protein and its Implications on Huntingtin Aggregation, in Journal of Molecular Biology, vol. 388, n. 5, 2009, pp. 919-927, DOI:10.1016/j.jmb.2009.01.032, PMC 2677131, PMID 19361448.
- ^ Susan W. Liebman e Stephen C. Meredith, Protein folding: Sticky N17 speeds huntingtin pile-up, in Nature Chemical Biology, vol. 6, n. 1, 2010, pp. 7-8, DOI:10.1038/nchembio.279, PMID 20016493.
- ^ Diwakar Shukla (membro del Pande lab) (10 febbraio 2012). "Project 8021 released to beta". Folding@home. phpBB Group. dall'originale il 20 settembre 2012. Estratto 17 marzo 2012. (È richiesta la registrazione)
- ^ M. Hollstein, D. Sidransky, B. Vogelstein e C. Harris, P53 mutations in human cancers, in Science, vol. 253, n. 5015, 1991, pp. 49-53, DOI:10.1126/science.1905840, PMID 1905840.
- ^ Lillian T. Chong, Christopher D. Snow, Young Min Rhee e Vijay S. Pande, Dimerization of the p53 Oligomerization Domain: Identification of a Folding Nucleus by Molecular Dynamics Simulations, in Journal of Molecular Biology, vol. 345, n. 4, 2005, pp. 869-878, DOI:10.1016/j.jmb.2004.10.083, PMID 15588832.
- ^ mah3, Vijay Pande (24 settembre 2004). "F@H project publishes results of cancer related research". MaximumPC.com. Future US, Inc. dall'originale il 20 settembre 2012. Richiamato 20 settembre, 2012. A nostra conoscenza, questo è il primo programma con risultati a revisione paritaria di un progetto di calcolo distribuito legato al cancro.
- ^ Lillian T. Chong, William C. Swope, Jed W. Pitera e Vijay S. Pande, Kinetic Computational Alanine Scanning: Application to p53 Oligomerization, in Journal of Molecular Biology, vol. 357, n. 3, 2006, pp. 1039-1049, DOI:10.1016/j.jmb.2005.12.083, PMID 16457841.
- ^ Mauro B. Almeida, José Luiz Martins Do Nascimento, Anderson Manoel Herculano e Maria Elena Crespo-López, Molecular chaperones: Toward new therapeutic tools, in Biomedicine & Pharmacotherapy, vol. 65, n. 4, 2011, pp. 239-243, DOI:10.1016/j.biopha.2011.04.025, PMID 21737228.
- ^ Vijay Pande (28 settembre 2007). "Nanomedicine center". Folding@home. typepad.com. dall'originale il 20 settembre 2012. Estratto 23 settembre 2011.
- ^ Vijay Pande (22 dicembre 2009). "Release of new Protomol (Core B4) WUs". Folding@home. typepad.com. dall'originale il 20 settembre 2012. Estratto 23 settembre 2011.
- ^ Pande lab. "Project 180 Description" Archiviato il 6 gennaio 2016 in Internet Archive.. Folding@home. Stanford University. dall'originale il 20 settembre 2012. Estratto 27 settembre 2011.
- ^ TJ Lane (membro del Pande lab) (8 giugno 2011). "Project 7600 in Beta". Folding@home. phpBB Group. dall'originale il 20 settembre 2012. Estratto 27 settembre 2011. (È richiesta la registrazione)
- ^ TJ Lane (membro del Pande lab) (8 giugno 2011). "Project 7600 Description" Archiviato il 6 gennaio 2016 in Internet Archive.. Folding@home. Stanford University. dall'originale il 20 settembre 2012. Estratto 31 marzo 2012.
- ^ "Scientists boost potency, reduce side effects of IL-2 protein used to treat cancer". MedicalXpress.com. Medical Xpress. 18 marzo 2012. dall'originale il 20 settembre 2012. Richiamato 20 settembre, 2012.
- ^ Aron M. Levin, Darren L. Bates, Aaron M. Ring, Carsten Krieg, Jack T. Lin, Leon Su, Ignacio Moraga, Miro E. Raeber, Gregory R. Bowman, Paul Novick, Vijay S. Pande, C. Garrison Fathman, Onur Boyman e K. Christopher Garcia, Exploiting a natural conformational switch to engineer an interleukin-2 'superkine', in Nature, vol. 484, n. 7395, 2012, pp. 529-533, DOI:10.1038/nature10975, PMC 3338870, PMID 22446627.
- ^ Frank Rauch e Francis H. Glorieux, Osteogenesis imperfecta, in The Lancet, vol. 363, n. 9418, 2004, pp. 1377-1385, DOI:10.1016/S0140-6736(04)16051-0, PMID 15110498.
- ^ Fratzl, Peter (2008). Collagen: structure and mechanics, ISBN [978-0-387-73905-2. Estratto 17 marzo 2012.
- ^ Alfonso Gautieri, Sebastien Uzel, Simone Vesentini, Alberto Redaelli e Markus J. Buehler, Molecular and Mesoscale Mechanisms of Osteogenesis Imperfecta Disease in Collagen Fibrils, in Biophysical Journal, vol. 97, n. 3, 2009, pp. 857-865, DOI:10.1016/j.bpj.2009.04.059, PMC 2718154, PMID 19651044.
- ^ Sanghyun Park, Randall J. Radmer, Teri E. Klein e Vijay S. Pande, A new set of molecular mechanics parameters for hydroxyproline and its use in molecular dynamics simulations of collagen-like peptides, in Journal of Computational Chemistry, vol. 26, n. 15, 2005, pp. 1612-1616, DOI:10.1002/jcc.20301, PMID 16170799.
- ^ Gregory Bowman (membro Pande lab). "Project 10125". Folding@home. phpBB Group. Estratto il 2 dicembre 2011. (È richiesta la registrazione)
- ^ Hana Robson Marsden, Itsuro Tomatsu e Alexander Kros, Model systems for membrane fusion, in Chem. Soc. Rev, vol. 40, n. 3, 2011, pp. 1572-1585, DOI:10.1039/c0cs00115e, PMID 21152599.
- ^ Peter Kasson (2012). "Peter M. Kasson" Archiviato il 3 settembre 2012 in Internet Archive.. Kasson lab. University of Virginia. dall'originale il 20 settembre 2012. Richiamato 20 settembre, 2012.
- ^ P. M. Kasson, A. Zomorodian, S. Park, N. Singhal, L. J. Guibas e V. S. Pande, Persistent voids: A new structural metric for membrane fusion, in Bioinformatics, vol. 23, n. 14, 2007, pp. 1753-1759, DOI:10.1093/bioinformatics/btm250, PMID 17488753.
- ^ Peter M. Kasson, Daniel L. Ensign e Vijay S. Pande, Combining Molecular Dynamics with Bayesian Analysis to Predict and Evaluate Ligand-Binding Mutations in Influenza Hemagglutinin, in Journal of the American Chemical Society, vol. 131, n. 32, 2009, pp. 11338-11340, DOI:10.1021/ja904557w, PMC 2737089, PMID 19637916.
- ^ Peter M. Kasson, Vijay S. Pande (2009). "Combining mutual information with structural analysis to screen for functionally important residues in influenza hemagglutinin". Pacific Symposium on Biocomputing: 492–503. PMC 2811693. PMID 19209725.
- ^ Vijay Pande (24 febbraio 2012). "Protein folding and viral infection". Folding@home. typepad.com. dall'originale il 20 settembre 2012. URL consultato 4 marzo 2012.
- ^ Vijay Pande (27 febbraio 2012). "New methods for computational drug design". Folding@home. typepad.com. dall'originale il 20 settembre 2012. URL consultato 1º aprile 2012.
- ^ Guha Jayachandran, Michael R. Shirts, Sanghyun Park e Vijay S. Pande, Parallelized-over-parts computation of absolute binding free energy with docking and molecular dynamics, in The Journal of Chemical Physics, vol. 125, n. 8, 2006, p. 084901, DOI:10.1063/1.2221680, PMID 16965051.
- ^ Pande lab. "Project 10721 Description" Archiviato il 6 gennaio 2016 in Internet Archive.. Folding@home. Stanford University. dall'originale il 20 settembre 2012. URL consultato 27 settembre 2011.
- ^ a b Gregory Bowman (23 luglio 2012). "Searching for new drug targets". Folding@home. typepad.com. dall'originale il 20 settembre 2012. URL consultato 27 settembre 2011.
- ^ G. R. Bowman e P. L. Geissler, Equilibrium fluctuations of a single folded protein reveal a multitude of potential cryptic allosteric sites, in Proceedings of the National Academy of Sciences, vol. 109, n. 29, 2012, pp. 11681-11686, DOI:10.1073/pnas.1209309109, PMC 3406870, PMID 22753506.
- ^ P. M. Petrone, C. D. Snow, D. Lucent e V. S. Pande, Side-chain recognition and gating in the ribosome exit tunnel, in Proceedings of the National Academy of Sciences, vol. 105, n. 43, 2008, pp. 16549-16554, DOI:10.1073/pnas.0801795105, PMC 2575457, PMID 18946046.
- ^ Pande lab. "Project 5765 Description" Archiviato il 6 gennaio 2016 in Internet Archive.. Folding@home. Stanford University. dall'originale il 20 settembre 2012. URL consultato 2 dicembre 2011.
- ^ a b Pande lab (4 aprile 2009). "Folding@home FLOP FAQ" Archiviato il 20 novembre 2012 in Internet Archive. (FAQ). Folding@home. Stanford University. Archiviato dall'originale il 21 settembre 2012. URL consultato 8 luglio 2013.
- ^ Vijay Pande (18 marzo 2009). "FLOPS". Folding@home. typepad.com. dall'originale il 20 settembre 2012. URL consultato 11 ottobre 2011.
- ^ a b c Pande lab (aggiornato giornalmente). "Client Statistics by OS" Archiviato il 3 settembre 2015 in Internet Archive.. Folding@home. Stanford University. dall'originale il 28 novembre 2012. URL consultato 8 luglio 2013.
- ^ a b Pande lab (30 maggio 2012). "PS3 FAQ" Archiviato il 18 agosto 2013 in Internet Archive. (FAQ). Folding@home. Stanford University. Archiviato dall'originale il 21 settembre 2012. URL consultato 8 luglio 2013.
- ^ "Most powerful distributed computing network". Guinnessworldrecords.com. Guinness World Records. 16 settembre 2007. dall'originale il 20 settembre 2012. URL consultato 20 settembre, 2012.
- ^ "BOINC Combined Credit Overview". BOINCstats.com. BOINC Stats. URL consultato 20 settembre, 2012.
- ^ Vijay Pande (28 novembre 2012). "New server stats reporting page". Folding@home. typepad.com. dall'originale il 28 novembre 2012. URL consultato 28 novembre 2011.
- ^ Shankland, Stephen (22 marzo 2002). "Google takes on supercomputing". CNet News. dall'originale il 20 settembre 2012. URL consultato 20 settembre, 2012.
- ^ a b "Futures in Biotech 27: Folding@home at 1.3 Petaflops"(Interview, webcast). Castroller.com. CastRoller. 28 dicembre 2007. dall'originale il 20 settembre 2012. URL consultato 20 settembre, 2012.
- ^ Google (2007). "Your computer's idle time is too precious to waste". Archiviato dall'originale 11 giugno 2008. URL consultato 31 agosto, 2012.
- ^ Vijay Pande, Stefan Larson (4 marzo 2002). "Genome@home Updates" Archiviato il 16 aprile 2004 in Internet Archive.. 15 aprile 2004. dall'originale il 20 settembre 2012. URL consultato 20 settembre, 2012.
- ^ Vijay Pande (16 settembre 2007). "Crossing the petaFLOPS barrier". Folding@home. typepad.com. dall'originale il 20 settembre 2012. URL consultato 28 agosto 2011.
- ^ a b Michael Gross, Folding research recruits unconventional help, in Current Biology, vol. 22, n. 2, 2012, pp. R35–R38, DOI:10.1016/j.cub.2012.01.008.
- ^ "TOP500 List — June 2007" Archiviato il 24 giugno 2019 in Internet Archive.. top500.org. Top500. giugno 2007. URL consultato 20 settembre, 2012.
- ^ "Folding@home reach 2 Petaflops". n4g.com. HAVAmedia. 8 maggio 2008. dall'originale il 20 settembre 2012. URL consultato 20 settembre, 2012.
- ^ "NVIDIA Achieves Monumental Folding@home Milestone With Cuda". nvidia.com. NVIDIA Corporation. 26 agosto 2008. URL consultato 20 settembre, 2012.
- ^ "3 PetaFLOP barrier". longecity.org. Longecity. 19 agosto 2008. dall'originale il 20 settembre 2012. URL consultato 20 settembre, 2012.
- ^ "Increase in 'active' PS3 folders pushes Folding@home past 4 Petaflops!". team52735.blogspot.com. Blogspot. 29 settembre 2008. dall'originale il 20 settembre 2012. URL consultato 20 settembre, 2012.
- ^ Vijay Pande (18 febbraio, 2009). "Folding@home Passes the 5 petaFLOP Mark". Folding@home. typepad.com. dall'originale il 20 settembre 2012. URL consultato 31 agosto, 2011.
- ^ "Crossing the 5 petaFLOPS barrier". longecity.org. Longecity. 18 febbraio 2009. dall'originale il 20 settembre 2012. URL consultato 20 settembre, 2012.
- ^ Dragan Zakic (maggio 2009). "Community Grid Computing — Studies in Parallel and Distributed Systems" Archiviato il 23 marzo 2012 in Internet Archive.. Massey University College of Sciences. Massey University. dall'originale il 20 settembre 2012. URL consultato 20 settembre, 2012.
- ^ William Ito. "A review of recent advances in ab initio protein folding by the Folding@home project". Stanford University. dall'originale il 22 settembre 2012. URL consultato 22 settembre 2012.
- ^ "TOP500 List — November 2008" Archiviato il 24 giugno 2019 in Internet Archive.. top500.org. TOP500. novembre 2008. URL consultato 20 settembre, 2012.
- ^ Jesse Victors (10 novembre 2011). "Six Native PetaFLOPS". Folding@home. phpBB Group. Archiviato dall'originale il 20 settembre 2012. URL consultato 11 novembre 2011.
- ^ a b c d e Pande lab (20 agosto 2012). "Folding@home Points FAQ" Archiviato il 17 luglio 2012 in Internet Archive. (FAQ). Folding@home. Stanford University. Archiviato dall'originale il 21 settembre 2012. URL consultato 8 luglio 2013.
- ^ Pande lab (23 luglio 2012). "Folding@home Passkey FAQ" Archiviato il 22 settembre 2012 in Internet Archive. (FAQ). Folding@home. Stanford University. Archiviato dall'originale il 21 settembre 2012. URL consultato 8 luglio 2013.
- ^ a b Peter Kasson (membro del Pande lab) (24 gennaio 2010). "upcoming release of SMP2 cores". Folding@home. phpBB Group. dall'originale il 20 settembre 2012. URL consultato 30 settembre 2011.
- ^ a b Pande lab (2012). "Folding@home homepage" Archiviato l'8 settembre 2012 in Internet Archive.. Folding@home. Stanford University. URL il 21 settembre 2012. Richiamato 8 luglio 2013.
- ^ "Official Extreme Overclocking Folding@home Team Forum". forums.extremeoverclocking.com. Extreme Overclocking. dall'originale il 20 settembre 2012. URL consultato 20 settembre, 2012.
- ^ a b c d e f g Adam L. Beberg, Daniel L. Ensign, Guha Jayachandran, Siraj Khaliq e Vijay S. Pande, Folding@home: Lessons from eight years of volunteer distributed computing, in 2009 IEEE International Symposium on Parallel & Distributed Processing, 2009, pp. 1-8, DOI:10.1109/IPDPS.2009.5160922, ISBN 978-1-4244-3751-1.
- ^ Norman Chan (6 aprile, 2009). "Help Maximum PC's Folding Team Win the Next Chimp Challenge!". Maximumpc.com. Future US, Inc. dall'originale il 20 settembre 2012. URL consultato 20 settembre, 2012.
- ^ a b c Pande lab (11 giugno 2012). "Folding@home SMP FAQ" Archiviato il 22 settembre 2012 in Internet Archive. (FAQ). Folding@home. Stanford University. Archiviato dall'originale il 21 settembre 2012. URL consultato 8 luglio 2013.
- ^ Vijay Pande (5 aprile 2011). "More transparency in testing". Folding@home. typepad.com. dall'originale il 20 settembre 2012. URL consultato 14 ottobre 2011.
- ^ Bruce Borden (7 agosto 2011). "Re: Gromacs Cannot Continue Further". Folding@home. phpBB Group. dall'originale il 20 settembre 2012. URL consultato 7 agosto 2011.
- ^ PantherX (1º ottobre 2011). "Re: Project 6803: (Run 4, Clone 66, Gen 255)". Folding@home. phpBB Group. dall'originale il 20 settembre 2012. URL consultato 9 ottobre 2011.
- ^ PantherX (31 ottobre 2010). "Troubleshooting Bad WUs". Folding@home. phpBB Group. dall'originale il 20 settembre 2012. URL consultato 7 agosto 2011.
- ^ Carsten Kutzner, David Van Der Spoel, Martin Fechner, Erik Lindahl, Udo W. Schmitt, Bert L. De Groot e Helmut Grubmüller, Speeding up parallel GROMACS on high-latency networks, in Journal of Computational Chemistry, vol. 28, n. 12, 2007, pp. 2075-2084, DOI:10.1002/jcc.20703, PMID 17405124.
- ^ Berk Hess, Carsten Kutzner, David Van Der Spoel e Erik Lindahl, GROMACS 4: Algorithms for Highly Efficient, Load-Balanced, and Scalable Molecular Simulation, in Journal of Chemical Theory and Computation, vol. 4, n. 3, 2008, pp. 435-447, DOI:10.1021/ct700301q, PMID 26620784.
- ^ Pande lab (19 agosto 2012). "Folding@home Gromacs FAQ" (FAQ). Folding@home. Stanford University. Archiviato dall'originale il 21 settembre 2012. URL consultato 8 luglio 2013.
- ^ Pande lab (7 agosto 2012). "Folding@home Frequently Asked Questions (FAQ) Index" Archiviato il 15 luglio 2013 in Internet Archive.. Folding@home. Stanford University. Archiviato dall'originale il 21 settembre 2012. URL consultato 8 luglio 2013.
- ^ Vijay Pande (25 settembre 2009). "Update on new FAH cores and clients". Folding@home. typepad.com. dall'originale il 20 settembre 2012. URL consultato 24 febbraio 2012.
- ^ a b Accelerating molecular dynamic simulation on graphics processing units, in Journal of Computational Chemistry, vol. 30, n. 6, 2009, pp. 864-872, DOI:10.1002/jcc.21209, PMC 2724265, PMID 19191337.
- ^ Pande lab (19 agosto 2012). "Folding@home Petaflop Initiative" Archiviato il 13 luglio 2012 in Internet Archive.
- ^ a b Pande lab (10 febbraio 2011). "Windows Uniprocessor Client Installation Guide" Archiviato il 20 novembre 2012 in Internet Archive. (Guide). Folding@home. Stanford University. Archiviato dall'originale il 21 settembre 2012. URL consultato 8 luglio 2013.
- ^ PantherX (2 settembre 2010). "Re: Can Folding@home damage any part of my PC?". Folding@home. phpBB Group. dall'originale il 20 settembre 2012. URL consultato 25 febbraio, 2012.
- ^ a b c Vijay Pande (17 giugno 2009). "How does FAH code development and sysadmin get done?". Folding@home. typepad.com. dall'originale il 20 settembre 2012. URL consultato 14 ottobre 2011.
- ^ Pande lab (30 maggio 2012). "Uninstalling Folding@home Guide" Archiviato il 17 luglio 2012 in Internet Archive. (Guide). Folding@home. Stanford University. Archiviato dall'originale il 21 settembre 2012. URL consultato 8 luglio 2013.
- ^ a b Folding@home developers. "FAHControl source code repository" Archiviato il 12 dicembre 2012 in Archive.is.. Stanford University. URL consultato 15 ottobre 2012.
- ^ Pande lab. "Folding@home Distributed Computing Client" Archiviato il 26 giugno 2012 in Internet Archive.. Folding@home. Stanford University. Archiviato dall'originale il 21 settembre 2012. URL consultato 8 luglio 2013.
- ^ Vijay Pande (28 giugno 2008). "Folding@home's End User License Agreement (EULA)". Folding@home. dall'originale il 20 settembre 2012. URL consultato 15 maggio, 2012.
- ^ unikuser (7 agosto 2011). "FoldingAtHome". Ubuntu Documentation. help.ubuntu.com. dall'originale il 22 settembre 2012. URL consultato 22 settembre 2012.
- ^ Phineus R. L. Markwick e J. Andrew McCammon, Studying functional dynamics in bio-molecules using accelerated molecular dynamics, in Physical Chemistry Chemical Physics, vol. 13, n. 45, 2011, pp. 20053-65, DOI:10.1039/C1CP22100K, PMID 22015376.
- ^ M. Shirts e V. S. Pande, COMPUTING: Screen Savers of the World Unite!, in Science, vol. 290, n. 5498, 2000, pp. 1903-1904, DOI:10.1126/science.290.5498.1903, PMID 17742054.
- ^ Pande lab. "Folding@home Executive summary" Archiviato il 7 ottobre 2012 in Internet Archive.. Folding@home. Stanford University. dall'originale il 21 settembre 2012. URL consultato 4 ottobre 2011.
- ^ Rattledagger, Vijay Pande (1º aprile 2005). "Folding@home client for BOINC in beta "soon"" Archiviato il 17 settembre 2012 in Internet Archive.. Boarddigger.com. AnandTech. dall'originale il 20 settembre 2012. URL consultato 20 settembre, 2012.
- ^ a b c Pande lab (30 maggio 2012). "High Performance FAQ" Archiviato il 19 agosto 2012 in Internet Archive. (FAQ). Folding@home. Stanford University. Archiviato dall'originale il 21 settembre 2012. URL consultato 8 luglio 2013.
- ^ John D. Owens, David Luebke, Naga Govindaraju, Mark Harris, Jens Krüger, Aaron E. Lefohn e Timothy J. Purcell, A Survey of General-Purpose Computation on Graphics Hardware, in Computer Graphics Forum, vol. 26, 2007, pp. 80-113, DOI:10.1111/j.1467-8659.2007.01012.x.
- ^ Peter Eastman e Vijay Pande, OpenMM: A Hardware-Independent Framework for Molecular Simulations, in Computing in Science & Engineering, vol. 12, n. 4, 2010, pp. 34-39, DOI:10.1109/MCSE.2010.27, PMC 4486654, PMID 26146490.
- ^ Imran S. Haque e Vijay S. Pande, Hard Data on Soft Errors: A Large-Scale Assessment of Real-World Error Rates in GPGPU, in 2010 10th IEEE/ACM International Conference on Cluster, Cloud and Grid Computing, 2010, pp. 691-696, DOI:10.1109/CCGRID.2010.84, ISBN 978-1-4244-6987-1.
- ^ a b c Pande lab (18 marzo 2011). "ATI FAQ" (FAQ). Folding@home. Stanford University. Archiviato dall'originale il 21 settembre 2012. URL consultato 8 luglio 2013.
- ^ Vijay Pande (23 maggio 2008). "GPU news (about GPU1, GPU2, & NVIDIA support)". Folding@home. typepad.com. dall'originale il 20 settembre 2012. URL consultato 8 settembre 2011.
- ^ Travis Desell, Anthony Waters, Malik Magdon-Ismail, Boleslaw K. Szymanski, Carlos A. Varela, Matthew Newby, Heidi Newberg, Andreas Przystawik e David Anderson (2009). "Accelerating the MilkyWay@Home volunteer computing project with GPUs". 8th International Conference on Parallel Processing and Applied Mathematics (PPAM 2009) Part I. pp. 276–288. doi:10.1.1.158.7614. ISBN 978-3-642-14389-2.
- ^ Vijay Pande (15 aprile, 2008). "Updates to the Download page/GPU2 goes live". Folding@home. typepad.com. Archiviato dall'originale il 20 settembre 2012. URL consultato 7 settembre 2011.
- ^ Vijay Pande (11 aprile 2008). "GPU2 open beta going well". Folding@home. typepad.com. dall'originale il 20 settembre 2012. URL consultato 7 settembre 2011.
- ^ a b Vijay Pande (24 aprile 2010). "Prepping for the GPU3 rolling: new client and NVIDIA FAH GPU clients will (in the future) need CUDA 2.2 or later". Folding@home. typepad.com. dall'originale il 20 settembre 2012. URL consultato 8 settembre 2011.
- ^ Joseph Coffland (CEO di Cauldron Development LLC & capo sviluppatore a Folding@home) (13 ottobre 2011). "Re: FAHClient V7.1.38 released (4th Open-Beta)". Folding@home. phpBB Group. dall'originale il 20 settembre 2012. URL consultato 15 ottobre 2011.
- ^ "NVIDIA GPU3 Linux/Wine Headless Install Guide". Folding@home. phpBB Group. 8 novembre 2008. dall'originale il 20 settembre 2012. URL consultato 5 settembre 2011.
- ^ a b Edgar Luttmann, Daniel L. Ensign, Vishal Vaidyanathan, Mike Houston, Noam Rimon, Jeppe Øland, Guha Jayachandran, Mark Friedrichs e Vijay S. Pande, Accelerating molecular dynamic simulation on the cell processor and Playstation 3, in Journal of Computational Chemistry, vol. 30, n. 2, 2009, pp. 268-274, DOI:10.1002/jcc.21054, PMID 18615421.
- ^ a b David E. Williams (20 ottobre 2006). "PlayStation's serious side: Fighting disease". CNN. dall'originale il 20 settembre 2012. URL consultato 20 settembre, 2012.
- ^ Jerry Liao (23 marzo 2007). "The Home Cure: PlayStation 3 to Help Study Causes of Cancer". mb.com. Manila Bulletin Publishing Corporation. dall'originale il 20 settembre 2012. URL consultato 20 settembre, 2012.
- ^ Lou Kesten, Associated Press (26 marzo 2007). "Week in video-game news: 'God of War II' storms the PS2; a PS3 research project" Archiviato il 20 giugno 2012 in Internet Archive.. Post-Gazette.com (Pittsburgh Post-Gazette). dall'originale il 20 settembre 2012. URL consultato 20 settembre, 2012.
- ^ Elaine Chow (18 settembre 2008). "PS3 News Service, Life With Playstation, Now Up For Download". Gizmodo.com. Gizmodo. dall'originale il 20 settembre 2012. URL consultato 20 settembre, 2012.
- ^ Vijay Pande (18 settembre 2008). "Life with Playstation – a new update to the FAH/PS3 client". Folding@home. typepad.com. dall'originale il 20 settembre 2012. URL consultato 24 febbraio 2012.
- ^ Eric Lempel (21 ottobre 2012). "PS3 System Software Update (v4.30)". PlayStation blog. Sony. dall'originale il 21 ottobre 2012. URL consultato 21 ottobre 2012.
- ^ "Termination of Life with PlayStation" Archiviato il 13 novembre 2012 in Internet Archive.. Life with PlayStation. Sony. 6 novembre 2012. dall'originale 8 novembre 2012. URL consultato 8 novembre 2012.
- ^ a b Vijay Pande (15 giugno 2008). "What does the SMP core do?". Folding@home. typepad.com. dall'originale il 20 settembre 2012. URL consultato 7 settembre 2011.
- ^ Daniel L. Ensign, Peter M. Kasson e Vijay S. Pande, Heterogeneity Even at the Speed Limit of Folding: Large-scale Molecular Dynamics Study of a Fast-folding Variant of the Villin Headpiece, in Journal of Molecular Biology, vol. 374, n. 3, 2007, pp. 806-816, DOI:10.1016/j.jmb.2007.09.069, PMC 3689540, PMID 17950314.
- ^ a b Vijay Pande (8 marzo 2008). "New Windows client/core development (SMP and classic clients)". Folding@home. typepad.com. dall'originale il 20 settembre 2012. URL consultato 30 settembre 2011.
- ^ a b Peter Kasson (membro del Pande lab) (15 luglio, 2009). "new release: extra-large work units". Folding@home. phpBB Group. dall'originale il 20 settembre 2012. URL consultato 9 ottobre 2011.
- ^ Vijay Pande (7 febbraio 2012). "Update on "bigadv-16", the new bigadv rollout". Folding@home. typepad.com. dall'originale il 20 settembre 2012. URL consultato 9 febbraio 2012.
- ^ Vijay Pande (2 luglio 2011). "Change in the points system for bigadv work units". Folding@home. typepad.com. dall'originale il 20 settembre 2012. URL consultato 24 febbraio 2012.
- ^ a b Pande lab (23 marzo 2012). "Windows (FAH V7) Installation Guide" Archiviato il 28 ottobre 2012 in Internet Archive. (Guide). Folding@home. Stanford University. Archiviato dall'originale il 21 settembre 2012. URL consultato 8 luglio 2013.
- ^ a b c Vijay Pande (29 marzo 2011). "Client version 7 now in open beta". Folding@home. typepad.com. dall'originale il 20 settembre 2012. URL consultato 14 agosto 2011.
- ^ Vijay Pande (31 marzo 2011). "Core 16 for ATI released; also note on NVIDIA GPU support for older boards". Folding@home. typepad.com. dall'originale il 20 settembre 2012. URL consultato 7 settembre 2011.
- ^ Vijay Pande (22 marzo 2012). "Web page revamp and v7 rollout". Folding@home. typepad.com. dall'originale il 20 settembre 2012. URL consultato 22 marzo 2012.
- ^ aschofield and jcoffland (3 ottobre 2011). "Ticket #736 (Link to GPL in FAHControl)" Archiviato il 28 maggio 2012 in Internet Archive.. Folding@home. Trac. dall'originale il 12 ottobre 2012. URL consultato il 12 maggio 2012.
- ^ Marc F. Lensink, Raúl Méndez e Shoshana J. Wodak, Docking and scoring protein complexes: CAPRI 3rd Edition, in Proteins: Structure, Function, and Bioinformatics, vol. 69, n. 4, 2007, pp. 704-718, DOI:10.1002/prot.21804, PMID 17918726.
- ^ Gregory R. Bowman e Vijay S. Pande, Simulated tempering yields insight into the low-resolution Rosetta scoring functions, in Proteins: Structure, Function, and Bioinformatics, vol. 74, n. 3, 2009, pp. 777-788, DOI:10.1002/prot.22210, PMID 18767152.
- ^ Gregory R. Bowman e Vijay S. Pande, The Roles of Entropy and Kinetics in Structure Prediction, in PLOS ONE, vol. 4, n. 6, 2009, pp. e5840, DOI:10.1371/journal.pone.0005840, PMC 2688754, PMID 19513117.
- ^ Gen_X_Accord, Vijay Pande (11 giugno 2006). "Folding@home vs. Rosetta@home". Rosetta@home forums. University of Washington. dall'originale il 20 settembre 2012. URL consultato 20 settembre, 2012.
- ^ Vijay Pande (13 ottobre 2011). "Comparison between FAH and Anton's approaches". Folding@home. typepad.com. dall'originale il 20 settembre 2012. URL consultato 25 febbraio, 2012.
- ^ a b c Thomas J. Lane, Gregory R. Bowman, Kyle Beauchamp, Vincent A. Voelz e Vijay S. Pande, Markov State Model Reveals Folding and Functional Dynamics in Ultra-Long MD Trajectories, in Journal of the American Chemical Society, vol. 133, n. 45, 2011, pp. 18413-18419, DOI:10.1021/ja207470h, PMC 3227799, PMID 21988563.
- ^ David E. Shaw, Kevin J. Bowers, Edmond Chow, Michael P. Eastwood, Douglas J. Ierardi, John L. Klepeis, Jeffrey S. Kuskin, Richard H. Larson, Kresten Lindorff-Larsen, Paul Maragakis, Mark A. Moraes, Ron O. Dror, Stefano Piana, Yibing Shan, Brian Towles, John K. Salmon, J. P. Grossman, Kenneth M. MacKenzie, Joseph A. Bank, Cliff Young, Martin M. Deneroff e Brannon Batson, Millisecond-scale molecular dynamics simulations on Anton, in Proceedings of the Conference on High Performance Computing Networking, Storage and Analysis - SC '09, 2009, p. 1, DOI:10.1145/1654059.1654099, ISBN 978-1-60558-744-8.
- ^ D. E. Shaw, P. Maragakis, K. Lindorff-Larsen, S. Piana, R. O. Dror, M. P. Eastwood, J. A. Bank, J. M. Jumper, J. K. Salmon, Y. Shan e W. Wriggers, Atomic-Level Characterization of the Structural Dynamics of Proteins, in Science, vol. 330, n. 6002, 2010, pp. 341-346, DOI:10.1126/science.1187409, PMID 20947758.
- ^ David E. Shaw, Jack C. Chao, Michael P. Eastwood, Joseph Gagliardo, J. P. Grossman, C. Richard Ho, Douglas J. Lerardi, István Kolossváry, John L. Klepeis, Timothy Layman, Christine McLeavey, Martin M. Deneroff, Mark A. Moraes, Rolf Mueller, Edward C. Priest, Yibing Shan, Jochen Spengler, Michael Theobald, Brian Towles, Stanley C. Wang, Ron O. Dror, Jeffrey S. Kuskin, Richard H. Larson, John K. Salmon, Cliff Young, Brannon Batson e Kevin J. Bowers, Anton, a special-purpose machine for molecular dynamics simulation, in Communications of the ACM, vol. 51, n. 7, 2008, p. 91, DOI:10.1145/1364782.1364802.
- ^ Ron O. Dror, Robert M. Dirks, J.P. Grossman, Huafeng Xu e David E. Shaw, Biomolecular Simulation: A Computational Microscope for Molecular Biology, in Annual Review of Biophysics, vol. 41, 2012, pp. 429-452, DOI:10.1146/annurev-biophys-042910-155245, PMID 22577825.
- ^ TJ Lane (membro del Pande lab) (6 giugno 2011). "Project 7610 & 7611 in Beta". Folding@home. phpBB Group. dall'originale il 20 settembre 2012. URL consultato 25 febbraio, 2012. (È richiesta la registrazione)
- ^ Pande lab. "Project 7610 Description" Archiviato il 6 gennaio 2016 in Internet Archive.. Folding@home. dall'originale il 20 settembre 2012. URL consultato 26 febbraio 2012.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Folding@home
Wikimedia Commons contiene immagini o altri file su Folding@home
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) Sito ufficiale, su foldingathome.org.
- (EN) Blog ufficiale, su foldingathome.org.
- FoldingAtHome (canale), su YouTube.
- Homepage di Folding@home, su folding.stanford.edu. URL consultato il 15 novembre 2005 (archiviato dall'url originale il 21 settembre 2012).
- Blog sulle news di Folding@home, su folding.typepad.com.
- Statistiche di Folding@home, su folding.stanford.edu. URL consultato il 12 agosto 2013 (archiviato dall'url originale il 15 luglio 2013).
- Lista delle pubblicazioni di Folding@home, su folding.stanford.edu.
- Libreria OpenMM, su simtk.org.









