In cristallografia, con il termine fattore di impaccamento atomico (o fattore di impilaggio o fattore di compattazione atomica o FCA o APF, dall'inglese Atomic packing factor) viene indicata la frazione del volume della struttura cristallina occupata dagli atomi.
Il fattore di impaccamento atomico è un numero adimensionale e assume valori compresi tra 0 e 1. Viene calcolato assumendo che ogni atomo sia rappresentato da una sfera rigida di raggio pari al raggio atomico.
Nel caso di cristalli costituiti da un singolo elemento chimico, il fattore di impaccamento atomico può essere ricavato dalla seguente relazione:
in cui:
- è il numero di "atomi" nella cella unitaria;
- è il volume di ciascun atomo;
- è il volume occupato da una cella unitaria.
Particolare attenzione bisogna prestare nel calcolare : infatti nel caso in cui un atomo si trova in un vertice di una cella cubica bisognerà contare solo 1/8 di atomo, in quanto solo 1/8 del suo volume è compreso nella cella, e allo stesso modo se si trova al centro di una faccia della cella, essendo "tagliato in due" dalla faccia bisognerà contare solo mezzo atomo, in quanto la restante parte di atomo non si trova all'interno della cella considerata. è quindi la somma di tutte queste "parti di atomi", che non corrisponde al numero di atomi che intersecano la cella unitaria.
Nel caso di struttura cristallina composta da un solo elemento, il massimo valore che può assumere il fattore di impaccamento atomico è pari a (nell'ipotesi di sfere rigide), mentre nel caso di struttura cristallina contenente più elementi si possono avere valori del fattore di impaccamento atomico maggiori di .
Calcolo del fattore di compattazione atomica
[modifica | modifica wikitesto]Reticolo cubico a facce centrate
[modifica | modifica wikitesto]
Nella cella cubica a facce centrate (CFC) ci sono 6 atomi al centro, ognuno contenuto per metà nella cella (condivisi con le celle adiacenti alle rispettive 6 facce), e 8 atomi ai vertici, ognuno contenuto per un ottavo nella cella (condivisi con le 8 celle adiacenti all'angolo), per cui il numero di atomi è:
Poiché gli atomi sono in contatto lungo le diagonali delle facce (sono direzioni a massimo impacchettamento), si può trovare il valore del parametro reticolare:
per cui il fattore di compattazione atomica:
Infatti come la struttura EC, il sistema CFC è a massimo impacchettamento.
Reticolo cubico a corpo centrato
[modifica | modifica wikitesto]
Nel caso di cella cubica a corpo centrato (CCC) in ogni cella ci sono 8 atomi ai vertici e 1 atomo al centro, per un totale di 9. Di questi 9 atomi solo quello centrale è interamente contenuto nella cella, mentre gli altri atomi occupano la cella solo con 1/8 del loro volume, per cui:
Si può osservare che la lunghezza della cella è correlata al raggio atomico attraverso la seguente relazione:
Sapendo che il volume di ogni atomo è pari a , si ottiene:
- In questo caso si parla di reticolo non compatto in quanto il volume occupato non corrisponde con il massimo valore possibile.
Reticolo esagonale compatto
[modifica | modifica wikitesto]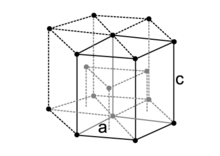
Nel caso del reticolo esagonale compatto (EC), indicando con il lato dell'esagono di base e con l'altezza della cella, si ottiene:
da cui:
Bibliografia
[modifica | modifica wikitesto]- Schaffer, Saxena, Antolovich, Sanders, and Warner, The Science and Design of Engineering Materials, Second Edition, New York, WCB/McGraw-Hill, 1999, pp. 81–88.
- Callister, W., Materials Science and Engineering, Sixth Edition, San Francisco, John Wiley and Sons, 2002, pp. 105–114.



























![{\displaystyle \mathrm {APF} ={\frac {N_{\mathrm {atomi} }V_{\mathrm {atomo} }}{V_{\mathrm {cellaunitaria} }}}={\frac {6(4/3)\pi r^{3}}{[(3{\sqrt {3}})/2]a^{2}c}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/85a0d3c73dbec41dfc3cd3fe8436ea36de3c49e4)
^{2}{\sqrt {\frac {2}{3}}}(4r)}}={\frac {6(4/3)\pi r^{3}}{[(3{\sqrt {3}})/2]{\sqrt {\frac {2}{3}}}(16r^{3})}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cb5766c048f9f0e27d09d90a7328762940709aff)
