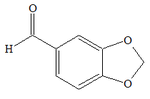
| Piperonale | |
|---|---|
 | |
| Nome IUPAC | |
| 3,4-(metilenediossi)benzaldeide 1,3-benzodiossol-5-carbossaldeide | |
| Nomi alternativi | |
| eliotropina piperonalio aldeide piperonilica | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C8H6O3 |
| Massa molecolare (u) | 150,13 |
| Aspetto | polvere cristallina |
| Numero CAS | |
| Numero EINECS | 204-409-7 |
| PubChem | 8438 |
| SMILES | C1OC2=C(O1)C=C(C=C2)C=O |
| Proprietà chimico-fisiche | |
| Solubilità in acqua | insolubile |
| Temperatura di fusione | 37 °C (310 K) |
| Temperatura di ebollizione | 263 °C (536 K) |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |

| |
| attenzione | |
| Frasi H | 315 - 319 - 335 |
| Consigli P | 261 - 305+351+338 - 302+352 - 321 - 405 - 501 [1][2] |
Il piperonale è un'aldeide aromatica.
A temperatura ambiente si presenta come una polvere cristallina bianca dall'odore floreale caratteristico.
Trova uso nella preparazione dei profumi ed è un intermedio della sintesi di stupefacenti amfetaminici come MDA e MDMA (Ecstasy).
Presenza in natura
[modifica | modifica wikitesto]Il piperonale si presenta naturalmente in varie piante. Alcuni esempi includono aneto, vaniglia, viole e pepe nero.
Preparazione
[modifica | modifica wikitesto]Il piperonale può essere preparato ossidando l'isosafrolo o usando una sequenza a più fasi da catecolo o 1,2-metilendiossibenzene. La sintesi di quest'ultima sostanza chimica viene effettuata attraverso una reazione di condensazione con acido gliossilico seguita da scissione dell'acido α-idrossi risultante con un agente ossidante.[3][4][5] La sintesi dal catecolo richiede un ulteriore passo, la sintesi di Williamson dell'etere usando diclorometano.[6]
Reazioni
[modifica | modifica wikitesto]Il piperonale, come tutte le aldeidi, può essere ridotto al suo alcool (alcol piperonilico) o ossidato per dare il suo acido (acido piperonilico).
Il piperonale può essere usato nella sintesi di alcuni farmaci tra cui tadalafil,[7] L-DOPA[8] e atrasentan.[9]
Fragranza
[modifica | modifica wikitesto]Il piperonale ha un odore floreale che è comunemente descritto come simile a quello di vanillina o ciliegia. Per questo motivo è comunemente usato nelle fragranze e nei sapori artificiali.[3] Il composto è stato chiamato eliotropina per via della fragranza del fiore di eliotropio (anche se la sostanza chimica non è presente nel vero aroma del fiore).[10] I profumieri iniziarono a usare la fragranza per la prima volta all'inizio del 1880.[11] È comunemente usato per aggiungere sfumature di vaniglia o mandorla, generalmente conferendo al profumo aspetti balsamici, talcati e floreali.[12]
Il piperonil acetato è un aroma sintetico di ciliegia.[13]
Note
[modifica | modifica wikitesto]- ^ Scheda del piperonale di Alfa-Aesar[collegamento interrotto]
- ^ Smaltire in accordo alle leggi vigenti.
- ^ a b Karl-Georg Fahlbusch, Franz-Josef Hammerschmidt, Johannes Panten, Wilhelm Pickenhagen, Dietmar Schatkowski, Kurt Bauer, Dorothea Garbe and Horst Surburg "Flavors and Fragrances" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2003. DOI: 10.1002/14356007.a11_141
- ^ Fatiadi, Alexander e Schaffer, Robert, An Improved Procedure for Synthesis of DL-4-Hydroxy-3-methoxymandelic Acid (DL-"Vanillyl"-mandelic Acid, VMA), in Journal of Research of the National Bureau of Standards Section A, 78A, n. 3, 1974, pp. 411-412, DOI:10.6028/jres.078A.024.
- ^ Stephen Nwaukwa e Philip Keehn, Oxidative cleavage of α-diols, α-diones, α-hydroxy-ketones and α-hydroxy- and α-keto acids with calcium hypochlorite [Ca(OCl)2], in Tetrahedron Letters, vol. 23, n. 31, 1982, pp. 3135-3138, DOI:10.1016/S0040-4039(00)88578-0.
- ^ Bonthrone, W. e Cornforth, J., The methylenation of catechols, in Journal of the Chemical Society, n. 9, 1969, pp. 1202-1204, DOI:10.1039/J39690001202.
- ^ Gilla, G., Anumula, R.R., Aalla, S., Vurimidi, H. e Ghanta, M.R., Synthesis and characterization of related substances and metabolite of tadalafil, a PDE-5 inhibitor (PDF), in Organic Communications, vol. 6, n. 1, 2013, pp. 12-22. URL consultato il 4 agosto 2020 (archiviato il 24 ottobre 2018).
- ^ Shun-Ichi Yamada, Tozo Fujii e Takayuki Shioiri, Studies on Optically Active Amino Acids. I. Preparation of 3-(3, 4-Methylenedioxyphenyl)-D-, and -L-alanine, in Chemical & Pharmaceutical Bulletin, vol. 10, n. 8, 1962, p. 680, DOI:10.1248/cpb.10.680.
- ^ Martin Winn, Thomas W. von Geldern, Terry J. Opgenorth, Hwan-Soo Jae, Andrew S. Tasker, Steven A. Boyd, Jeffrey A. Kester, Robert A. Mantei, Radhika Bal, Bryan K. Sorensen, Jinshyun R. Wu-Wong, William J. Chiou, Douglas B. Dixon, Eugene I. Novosad, Lisa Hernandez e Kennan C. Marsh, 2,4-Diarylpyrrolidine-3-carboxylic AcidsPotent ETASelective Endothelin Receptor Antagonists. 1. Discovery of A-127722, in Journal of Medicinal Chemistry, vol. 39, n. 5, 1996, pp. 1039-1048, DOI:10.1021/jm9505369, ISSN 0022-2623.
- ^ Copia archiviata, su bojensen.net. URL consultato il 4 agosto 2020 (archiviato il 23 dicembre 2019).
- ^ The Force of Fashion in Politics and Society: Global Perspectives from Early Modern to Contemporary Times By Beverly Lemire ISBN 9781409404927
- ^ The Good Scents Company database entry for Heliotropin Archiviato il 1º agosto 2020 in Internet Archive.
- ^ Fenaroli's Handbook of Flavor Ingredients.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Piperonale
Wikimedia Commons contiene immagini o altri file su Piperonale








