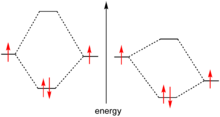
Il doppietto elettronico è la coppia di elettroni che occupano lo stesso orbitale, ma presentano spin opposti (in accordo con il principio di esclusione di Pauli).
Gli elettroni di un doppietto elettronico possono essere:
- condivisi da due atomi nel legame covalente (puro o polare)
- non condivisi
- elettroni di core, nel caso in cui occupino i livelli energetici più interni di un atomo, ovvero se non sono elettroni di valenza.
In molti casi due atomi possono condividere fino a tre coppie di elettroni (triplo legame). Infatti nel caso in cui nel livello energetico più esterno di un atomo vi siano 8 elettroni, si dice che l'atomo possiede un "ottetto completo", e secondo la regola dell'ottetto l'atomo in questione sarà stabile. Ad esempio i gas nobili possiedono l'ottetto completo, per cui sono dotati di una elevata stabilità.[1]
Coppia solitaria
[modifica | modifica wikitesto]Un doppietto elettronico non condiviso (o coppia solitaria, in inglese lone pair ) viene indicato con due punti (":") o con una stanghetta.

I doppietti solitari possono dare luogo a legami dativi.

Essendo costituiti da cariche negative (elettroni), hanno un'azione di repulsione nei confronti degli altre coppie elettroniche presenti in una molecola. Per questo motivo, ad esempio, la molecola di ammoniaca (NH3) non è esattamente tetraedrica, in quanto le coppie di legame N–H vengono respinte dal doppietto non condiviso presente sull'atomo di azoto. Ne consegue che l'angolo formato dai legami tra idrogeno e azoto nella molecola di ammoniaca non è di 109,5° (angolo tetraedrico), bensì di 107°.
Note
[modifica | modifica wikitesto]- ^ Sebbene esistano alcuni composti dei gas nobili.
Voci correlate
[modifica | modifica wikitesto]- Elettrone
- Regola dell'ottetto
- Struttura di Lewis
- Elettrone di core
- Legame chimico
- Elettrondonatore
- Elettrone spaiato
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) electron pair, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.








