| Cloruro di metilmagnesio | |
|---|---|
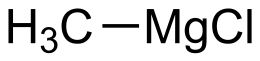 | |
| Caratteristiche generali | |
| Formula bruta o molecolare | CH3ClMg |
| Massa molecolare (u) | 74,79 |
| Aspetto | solido incolore liquido grigio in soluzione[1] |
| Numero CAS | |
| Numero EINECS | 211-629-7 |
| PubChem | 12670 |
| SMILES | C[Mg+].[Cl-] |
| Indicazioni di sicurezza | |
| Punto di fiamma | -17,2 °C |
| Temperatura di autoignizione | 320,6 °C |
| Simboli di rischio chimico | |
   
| |
| pericolo | |
| Frasi H | 225 - 260 - 302 - 314 - 335 - 336 - 351 - EUH014 - EUH019 [1] |
| Consigli P | 210 - 231+232 - 280 - 303+361+353 - 304+340+310 - 305+351+338 [1] |
Il cloruro di metilmagnesio è il composto organometallico con formula CH3MgCl. È il più semplice tra i reattivi di Grignard. In condizioni normali è un solido incolore, insolubile in etere di petrolio e benzene,[2] disponibile in commercio come soluzione in tetraidrofurano.[1] In chimica organica viene utilizzato come sintone del carbanione metilico, in maniera analoga al metillitio.
Sintesi
[modifica | modifica wikitesto]Il cloruro di metilmagnesio si prepara facendo reagire clorometano con magnesio in tetraidrofurano. La soluzione così ottenuta viene usata direttamente come reattivo di Grignard, senza bisogno di isolare il composto.[3] Analoga reazione si può condurre anche in etere.[4]
Proprietà
[modifica | modifica wikitesto]
Il cloruro di metilmagnesio è stabile in soluzione di tetraidrofurano. È un tipico reattivo di Grignard, meno usato dei corrispondenti bromuro e ioduro, ma di costo inferiore.[3] In solventi di tipo etere è solvatato: due atomi di ossigeno del solvente si coordinano all'atomo di magnesio che diventa tetracoordinato con geometria tetraedrica.
Il cloruro di metilmagnesio reagisce con l'acqua e altri reagenti protici per formare metano:
Note
[modifica | modifica wikitesto]Bibliografia
[modifica | modifica wikitesto]- (EN) F. Bickelhaupt e O. S. Akkerman, Magnesium Compounds, in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 2002, DOI:10.1002/14356007.a15_595.
- (EN) E. R. Coburn, 3-Penten-2-ol, in Org. Synth., vol. 27, 1947, pp. 65, DOI:10.15227/orgsyn.027.0065.
- (EN) W. M. Haynes (a cura di), CRC Handbook of Chemistry and Physics, 96ª ed., Boca Raton, CRC Press, 2015, ISBN 978-1-4822-6097-7.
- Sigma-Aldrich, Scheda di dati di sicurezza di Cloruro di metilmagnesio, Soluzione, su sigmaaldrich.com, 2021. URL consultato l'11 aprile 2022.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Cloruro di metilmagnesio
Wikimedia Commons contiene immagini o altri file su Cloruro di metilmagnesio









![{\displaystyle {\ce {CH3Cl~+Mg->[{} \atop {\ce {THF}}]CH3MgCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8881aa953f5fef8badb1370e8eb598a3efff62d3)
