Lo ione bisolfito (o, come raccomandato dalla nomenclatura IUPAC, idrogenotriossosolfito) è l'anione acido di zolfo HSO3−, con lo zolfo in stato di ossidazione +4.
I sali contenenti questo ione sono detti bisolfiti, o più correttamente (nomenclatura IUPAC) idrogenosolfiti.
Reazioni
[modifica | modifica wikitesto]I sali idrogenosolfiti sono tipicamente preparati dal trattamento di una soluzione alcalina con eccesso di anidride solforosa, per esempio nel caso del bisolfito di sodio:
HSO3− è la base coniugata dell'acido solforoso, H2SO3:
L'acido solforoso non è un composto isolabile e non sembra esistere neanche in soluzione. Un equilibrio più reale rivelato con l'aiuto della spettroscopia è il seguente:
HSO3− è uno ione leggermente acido con una pKa di 6.97. È l'acido coniugato dello ione solfito, SO32−:
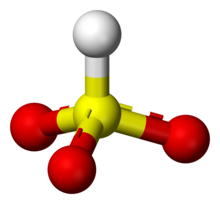
Struttura
[modifica | modifica wikitesto]

La maggior parte degli ioni bisolfito ha l'atomo di idrogeno collocato sull'atomo di zolfo, tuttavia alcuni esperimenti hanno dimostrato tramite la spettroscopia a risonanza magnetica nucleare che due tautomeri dell'idrogenosolfito coesistono in equilibrio, una avente simmetria C3v (protonato allo zolfo) ed un altro la simmetria Cs (protonato all'ossigeno).[1] La struttura C3v è supportata anche da diverse cristallografie a raggi X.
Note
[modifica | modifica wikitesto]- ^ D. A. Horner, R. E. Connick, Inorg. Chem. 25, 2414-7 (1986).
Altri progetti
[modifica | modifica wikitesto] Wikizionario contiene il lemma di dizionario «bisolfito»
Wikizionario contiene il lemma di dizionario «bisolfito» Wikimedia Commons contiene immagini o altri file su bisolfito
Wikimedia Commons contiene immagini o altri file su bisolfito












