| Tiosolfato d'ammonio | |
|---|---|
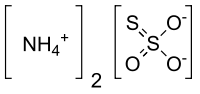 | |
 | |
| Nome IUPAC | |
| diammonio tiosolfato | |
| Nomi alternativi | |
| ammonio tiosolfato | |
| Caratteristiche generali | |
| Formula bruta o molecolare | (NH4)2S2O3 |
| Massa molecolare (u) | 148,21 g/mol |
| Aspetto | solido bianco |
| Numero CAS | |
| Numero EINECS | 231-982-0 |
| PubChem | 6096946 |
| SMILES | [O-]S([O-])(=O)=S.[NH4+].[NH4+] |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,64 g/cm³ (23 °C) |
| Solubilità in acqua | 1800 g·L−1(20 °C)[1] |
| Temperatura di fusione | 150 °C (423 K) (decomposizione) |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 2890 mg·kg−1 (ratto, per os)[1] |
| Indicazioni di sicurezza | |
| Frasi H | -- |
| Consigli P | -- [2] |
Il tiosolfato d'ammonio è un sale inorganico d'ammonio dell'acido tiosolforico, avente formula (NH4)2S2O3.
A temperatura ambiente si presenta come un solido cristallino bianco, avente odore di ammoniaca.
Esso si scioglie rapidamente e completamente in acqua, mentre è poco solubile in acetone e insolubile in etanolo e etere dietilico[3].
Preparazione
[modifica | modifica wikitesto]Il tiosolfato d'ammonio può essere ottenuto:
- per reazione del solfito di ammonio con zolfo o solfuri in soluzioni acquose (eventualmente con ammoniaca)[4]:
- per reazione del bicarbonato di ammonio con anidride solforosa a formare solfito ammonico e successiva reazione di questo con zolfo o solfuri[5]:
- per ossidazione del solfuro di idrogeno.
Proprietà
[modifica | modifica wikitesto]Il tiosolfato d'ammonio si decompone a temperatura superiore a 150 °C, sviluppando ossidi di zolfo, ammoniaca, ossidi di azoto[1].
Uso del tiosolfato di ammonio
[modifica | modifica wikitesto]Utilizzo in agricoltura
[modifica | modifica wikitesto]Il tiosolfato d'ammonio è utilizzato in agricoltura come fertilizzante in grado di fornire alle piante azoto ammoniacale[6]. Inoltre, il tiosolfato d'ammonio, in formulazione adatta, è usato per il diradamento dei fiori delle pomacee e delle drupacee. Infatti il tiosolfato di ammonio brucia i fiori aperti non fecondati. Dalle ricerche condotte dal Centro di Consulenza (Beratungsring) dell'Alto Adige, i prodotti commerciali contenenti tiosolfato di ammonio più adatti allo scopo sono GER ATS e Azos 300, perché bruciano i fiori non fecondati aperti senza bruciare le foglie e le altre parti verdi delle piante trattate. Il diradamento, nel melo, è una pratica fondamentale per ottenere produzioni di qualità. Il problema del diradamento è particolarmente importante nella varietà di mele Fuji sulla quale non sono efficaci, o sono scarsamente efficaci, altri diradanti.
Utilizzo in fotografia
[modifica | modifica wikitesto]Il tiosolfato di ammonio è anche un componente dei fissaggi fotografici e radiografici "rapidi". Infatti, i fissatori a base di tiosolfato d'ammonio agiscono più rapidamente dei fissatori a base di tiosolfato di sodio[7]. Nei fissatori concentrati, il tiosolfato d'ammonio è in soluzione al 40-45%; in quelli pronti all'uso, è in soluzione al 10-15%.
Altri utilizzi industriali
[modifica | modifica wikitesto]Il tiosolfato d'ammonio è utilizzato anche nell'estrazione di oro e argento, in presenza di rame come catalizzatore, in un processo ecocompatibile alternativo a quello maggiormente utilizzato che impiega lo ione cianuro[8]. Inoltre il tiosolfato d'Ammonio, viene utilizzato nella reazione tra idrossido di sodio e alluminio, per evitare il surriscaldamento della reazione. Per l'elevato costo, si tende ad estrarre il tiosolfato di ammonio dal tabacco, infondendolo, prima di aggiungere il resto dei reagenti.
Inoltre, come indicato da alcune ricerche, può essere utilizzato nella termodistruzione di rifiuti, come additivo a miscele di carbone-rifiuti, per ridurre la formazione di diossine e furani[9].
Note
[modifica | modifica wikitesto]- ^ a b c Ammonium thiosulfate Archiviato il 30 dicembre 2013 in Internet Archive. - GESTIS Substance Database - IFA.
- ^ scheda del tiosolfato d'ammonio sostanza su IFA-GESTIS Archiviato il 16 ottobre 2019 in Internet Archive.
- ^ MSDS - Ammonium Thiosulfate
- ^ Karl Heinz Büchel, Hans-Heinrich Moretto, Peter Woditsch: Industrial Inorganic Chemistry. ISBN 978-3-527-29849-5.
- ^ Verfahren zur Herstellung von Ammoniumthiosulfat (Patent.de), su patent-de.com. URL consultato il 29 dicembre 2013 (archiviato dall'url originale il 4 marzo 2016).
- ^ (CS) Minerální hnojiva se sírou
- ^ (CS) Praní černobílých filmů a papírů Archiviato il 27 marzo 2012 in Internet Archive.
- ^ M. G Aylmore e D. M Muir, Thiosulfate leaching of gold—A review, in Minerals Engineering, vol. 14, n. 2, 1º febbraio 2001, pp. 135–174, DOI:10.1016/S0892-6875(00)00172-2. URL consultato il 9 settembre 2023.
- ^ (CS) Ekologický monitor. Krátké zprávy ze zahraničních periodik – 19.1.2006 Archiviato il 27 marzo 2012 in Internet Archive.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Tiosolfato d'ammonio
Wikimedia Commons contiene immagini o altri file su Tiosolfato d'ammonio
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) ammonium thiosulfate, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.












