| 3-iodopropene | |
|---|---|
 | |
| Nomi alternativi | |
| ioduro di allile | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C3H5I |
| Massa molecolare (u) | 167,98 |
| Aspetto | liquido giallo di odore pungente[1] |
| Numero CAS | |
| Numero EINECS | 209-130-4 |
| PubChem | 11166 |
| SMILES | C=CCI |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,84[1] |
| Indice di rifrazione | 1,5540[2] |
| Solubilità in acqua | 3,8 g/l a 25 ºC[1] |
| Temperatura di fusione | −99 °C (174 K)[1] |
| Temperatura di ebollizione | 102 °C (375 K)[1] |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 10 oral rat[1] |
| Indicazioni di sicurezza | |
| Punto di fiamma | 5 ºC[1] |
| Temperatura di autoignizione | 295 ºC[1] |
| Simboli di rischio chimico | |
  
| |
| pericolo | |
| Frasi H | 225 - 300 - 314 [1] |
| Consigli P | 210 - 240 - 280 - 301+330+331 - 305+351+338 - 310 [1] |
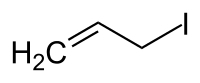
Il 3-iodopropene, comunemente chiamato ioduro di allile, è un alogenuro alchilico insaturo di formula CH2=CH–CH2–I. In condizioni normali il composto è un liquido di colore giallo chiaro.
Sintesi
[modifica | modifica wikitesto]Il composto fu descritto per la prima volta nel 1855 da Marcellin Berthelot, che lo ottenne facendo reagire ioduro di fosforo e glicerolo.[3] Metodi di sintesi più recenti includono la reazione dell'alcool allilico con ioduro di metile e trifenilfosfito,[4] la reazione di Finkelstein su alogenuri di allile,[5] o la reazione di fosforo e iodio con glicerolo.[6]
Reattività
[modifica | modifica wikitesto]Lo ioduro di allile è un composto stabile, ma sensibile al calore e alla luce. La decomposizione rilascia iodio che impartisce un colore rosso al liquido. Soluzioni in esano possono essere conservate al buio a -5 ºC per tre mesi prima che sia rilevabile la formazione di iodio libero.[7]
Applicazioni
[modifica | modifica wikitesto]Lo ioduro di allile è usato per la sintesi di altri composti organici come N-alchil pirrolidoni,[8] esteri dell'acido sorbico,[8] acidi barbiturici sostituiti,[9] e composti organometallici contenenti il leganti allile.[10]
Tossicità / Indicazioni di sicurezza
[modifica | modifica wikitesto]Il composto è disponibile in commercio. È un liquido facilmente infiammabile che provoca gravi ustioni agli occhi e alle mucose. Non risultano rischi di cancerogenicità.[1]
Note
[modifica | modifica wikitesto]Bibliografia
[modifica | modifica wikitesto]- (EN) R. Adams (a cura di), Organic Reactions, New York, John Wiley & Sons, 1944.
- (EN) A. Behr, Organometallic Compounds and Homogeneous Catalysis, in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 2002, DOI:10.1002/14356007.a18_215.
- (FR) M. Berthelot e S. De Luca, Action de l'iodure de phosphore sur la glycérine, in Ann. Chim. Phys., vol. 43, 1855, pp. 257-283.
- (EN) W. Bertleff, Carbonylation, in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 2002, DOI:10.1002/14356007.a05_217.
- (EN) R. L. Datta, The Preparation of Allyl Iodide, in J. Am. Chem. Soc., vol. 36, n. 5, 1914, pp. 1005-1007, DOI:10.1021/ja02182a023.
- GESTIS, 3-Iodpropene, su gestis-en.itrust.de, 2018. URL consultato il 18 maggio 2018 (archiviato dall'url originale il 20 maggio 2018). Pagina del 3-iodopropene nel data base GESTIS.
- D. R. Lide (Editor), CRC Handbook of Chemistry and Physics, Internet Version 2005, su hbcponline.com, CRC Press, Boca Raton, 2005. URL consultato il 9 dicembre 2017.
- (EN) P. Patnaik, A comprehensive guide to the hazardous properties of chemical substances, 3ª ed., Wiley-Interscience, 2007, p. 480, ISBN 0-471-71458-5.
- (EN) D. J. Sibbett e R. M. Noyes, Kinetics of the Thermal Exchange between Iodine and Allyl Iodide, in J. Am. Chem. Soc., vol. 75, n. 4, 1953, pp. 761-763, DOI:10.1021/ja01100a001.
- (EN) H. Wollweber, Hypnotics, in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 2002, DOI:10.1002/14356007.a13_533.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su ioduro di allile
Wikimedia Commons contiene immagini o altri file su ioduro di allile








