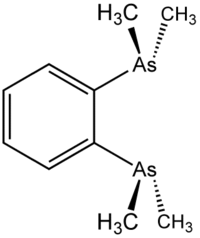
| 1,2-bis(dimetilarsino)benzene | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| 1,2-Bis(dimetilarsino)benzene | |
| Nomi alternativi | |
| diars | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C10H16As2 |
| Massa molecolare (u) | 286,0772 |
| Aspetto | liquido incolore |
| Numero CAS | |
| Numero EINECS | 236-227-9 |
| PubChem | 83261 |
| SMILES | C[As](C)C1=CC=CC=C1[As](C)C |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,3992 |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
Il 1,2-bis(dimetilarsino)benzene, abbreviato in genere come diars,[1] è il composto chimico di formula C6H4(As(CH3)2)2. In condizioni normali è un liquido incolore. Viene usato come legante chelato in chimica organometallica.
Sintesi e reattività
[modifica | modifica wikitesto]Il diars si prepara per reazione tra 1,2-diclorobenzene e dimetilarseniuro di sodio:[2]
- C6H4Cl2 + 2NaAs(CH3)2 → C6H4(As(CH3)2)2 + 2NaCl
In presenza di ossigeno il diars reagisce formando il diossido, C6H4(As(CH3)2O)2.
Chimica di coordinazione
[modifica | modifica wikitesto]Il diars fu preparato per la prima volta nel 1939 da Joseph Chatt e Frederick Mann,[3] ma diventò ben noto solo dopo l'utilizzo che ne fece Ronald Nyholm per preparare complessi metallici con stati di ossidazione e numeri di coordinazione inusuali. Il diars può formare complessi a numero di coordinazione elevato perché è un legante piuttosto compatto e le distanze di legame As–M sono lunghe, in modo da evitare l'affollamento attorno al centro metallico. Alcuni esempi significativi sono i seguenti:
- [Ni(diars)2Cl2]Cl e [Ni(diars)2Cl2][ClO4]2, i primi complessi ottaedrici di Ni(III) e Ni(IV) preparati da Nyholm.[4][5]
- TiCl4(diars)2, uno dei primi complessi a numero di coordinazione otto dei metalli 3d.[6]
- [Fe(diars)2X2]2+ (X = Cl, Br, I), rari casi di complessi del ferro con stato di ossidazione maggiore di +3.[7]
- [Au(diars)2I2]+, raro caso di complesso di Au(III) con numero di coordinazione maggiore di 4.[8]
Indicazioni di sicurezza
[modifica | modifica wikitesto]Il diars non è disponibile in commercio. Il composto non è classificato esplicitamente nella Direttiva 67/548/CE, ma come composto dell'arsenico va considerato molto tossico e pericoloso per l'ambiente.
Note
[modifica | modifica wikitesto]- ^ Holleman e Wiberg 2001.
- ^ Feltham e Silverthorn 1967.
- ^ Chatt e Mann 1939.
- ^ Nyholm 1950.
- ^ Nyholm 1951.
- ^ Greenwood e Earnshaw 1997, p. 967.
- ^ Greenwood e Earnshaw 1997, p. 1088.
- ^ Greenwood e Earnshaw 1997, p. 1188.
Bibliografia
[modifica | modifica wikitesto]- J. Chatt e F. G. Mann, 139. The synthesis of ditertiary arsines. meso- and racemic forms of bis-4-covalent-arsenic compounds, in J. Chem. Soc., 1939, pp. 610-615, DOI:10.1039/JR9390000610.
- R. D. Feltham e W. Silverthorn, o-Phenylenebis(dimethylarsine), in Inorg. Synth., vol. 10, 1967, pp. 159–164.
- N. N. Greenwood e A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- A. F. Holleman e E. Wiberg, Inorganic chemistry, San Diego, Academic Press, 2001, ISBN 0-12-352651-5.
- R. S. Nyholm, Trivalent nickel, in Nature, vol. 165, 1950, pp. 154, DOI:10.1038/165154a0.
- R. S. Nyholm, Studies in co-ordination chemistry. Part IX. Quadrivalent nickel, in J. Chem. Soc., 1951, pp. 2602-2607, DOI:10.1039/JR9510002602.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su 1,2-bis(dimetilarsino)benzene
Wikimedia Commons contiene immagini o altri file su 1,2-bis(dimetilarsino)benzene








