Atopobium
| Atopobium | |
|---|---|
 | |
| Classificazione scientifica | |
| Dominio | Prokaryota |
| Regno | Bacteria |
| Phylum | Actinobacteria |
| Classe | Actinobacteria |
| Sottoclasse | Coriobacteridae |
| Ordine | Coriobacteriales |
| Famiglia | Coriobacteriaceae |
| Genere | Atopobium Collins and Wallbanks, 1993 |
| Specie | |
Atopobium Collins and Wallbanks, 1993 è un genere di batteri appartenente agli Actinobacteria, della famiglia dei Coriobacteriaceae.[1]
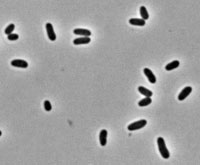
Le specie di Atopobium sono batteri anaerobici facoltativi, cocchi Gram-positivi di forma ellittica o a bastoncello che si trovano come elementi singoli o in coppia o in corte catene.
Atopobium vaginae è stato scoperto da Rodriguez [2] nel 1999 ed è un comunemente presente nella vagina della donna con vaginosi batterica.
Questo è un batterio anaerobo facoltativo, Gram-positivo che non si riesce ad isolare con la microbiologia classica [3]; è presente in corso di vaginosi batterica secondo Burton nel 50% dei casi [4][5]; secondo Ferris [6] è presente fino al 70 % in corso di vaginosi batterica.
Specie
[modifica | modifica wikitesto]Il Genere Atopobium è costituito dalle seguenti specie:[7]
- Atopobium rimae [20]
- isolato in un caso di batteriemia da cirrosi epatica [21] e in periodontiti del cavo orale
- Atopobium vaginae [22]
- isolato nella vagina e nel tratto urinario dell'uomo
Batteriologia
[modifica | modifica wikitesto]Il genere Atopobium fu proposto per la prima volta nel 1992. L'Atopobium vaginae è stato isolato dalla flora vaginale di persone sane e non. Esso è un batterio anaerobo facoltativo, Gram-positivo a forma di cocco ellittico o bastoncello, che forma piccole colonie su agar sangue a 37 °C, misura approssimativamente 0,6-0.9 mcm; positivo alla fosfatasi acida ed è indolo-negativo. Non produce acido dal metabolismo del mannosio e del raffinosio ed ha una debole attività per gli enzimi:
- fenilalanina arilamidasi
- a-arabinoside,
- cistina arilamidasi,
- chimotripsina,
- lipasi-esterasica C8,
- esterasi C4,
- alfa-fucosidasi,
- alfa-galactosidasi,* beta-galattosidasi,
- beta-galattosidasi 6-fosfato,
- acido glutamico decarbossilasi,
- acido glutamilglutamico,
- acido arilamidasi,
- beta-glucuronidasi,
- alfa-mannosidasi,
- beta-N-acetilglucosaminidasi,
- lipasi C 14,
- acido piroglutamico arilamidasi,
- tirosina arilamidase
gli enzimi tripsina o l'ureasi non sono rintracciati. Non è in grado di ridurre il nitrato e di idrolizzare la legatina e l'esculina [2] . Il ceppo tipo (usato per le ricerche microbiologiche) è il CCUG 38953T [2].
L'Atopobium vaginae rispetto al genere Atopobium ha approssimativamente un range di divergenza dell'16s rRNA del 3-8% [23][24]; divergenza genetica che ha permesso di riconoscerlo come una nuova specie [2].
Biochimica differenziale del genere Atopobium
[modifica | modifica wikitesto]Secondo Rodriguez, in base all'attività enzimatica, possono essere distinte le seguente specie di Atopobium:[25]
Diversità enzimatiche comparate tra le varie specie di Atopobium
| Enzima | A. vaginae | A. minutum | A. parvulum | A. rimae |
|---|---|---|---|---|
| Fosfatasi acida | + | - | + | + |
| Alanina arilamidasi | - | - | + | - |
| Arginina diidrolasi | + | + | - | - |
| Arginina arilamidasi | + | + | + | - |
| Istidina arilamidasi | + | - | - | - |
| beta-Galactosidasi | - | - | + | - |
| Leucina arilamidasi | + | - | + | - |
| Prolina arilamidasi | + | + | - | - |
| Ac. piroglutamico arilamidasi | - | v | + | + |
| Glicina arilamidasi | + | - | + | - |
| Serina arilamidasi | + | - | - | - |
| Tirosina arilamidasi | - | - | + | - |
| Legenda |
|---|
| +, l'espressione dell'enzima è costitutiva |
| -, l'enzima è assente e non inducibile |
| v, l'espressione dell'enzima è variabile |
Storia
[modifica | modifica wikitesto]Il genere Atopobium fu proposto per la prima volta nel 1992 [23], a questo genere appartenevano batteri isolati, precedentemente classificati come Lactobacillus minitus, L. Rimae e Streptococcus parvulus. Il primo isolamento dell'Atopobium vaginae da materiale vaginale si deve a Rodriguez e coll. dell'Department of Microbiology, BBSRC Institute of Food Research, Reading, UK. nel 1999, che grazie a tecniche di sequenziamento del RNA-ribosomiale 16S, individuarono per primi una nuova specie appartenente al genere Atopobium [26].
L'aspetto di questo batterio alla colorazione di Gram è quello di un piccolo cocco Gram-positivo anaerobo facoltativo. I membri del genere sono noti per produrre grandi quantità di acido lattico per questo motivo alcune specie appartenenti al genere Atopobium sono stati inizialmente identificati come Lactobacillus sp. Fu, infatti, nel corso di uno studio di lattobacilli vaginali che l'A. vaginae fu identificato (Rodriguez 1999).
Epidemiologia
[modifica | modifica wikitesto]Studi condotti su donne adulte con normale flora vaginale hanno riportato che la prevalenza dell'A. vaginae determinata con la PCR oscilla tra l'8% e il 20% in donne asintomatiche; mentre le donne che hanno una vaginosi batterica in atto le percentuali di ritrovamento sono comprese tra il 54% e il 78% [27] [28].
Clinica
[modifica | modifica wikitesto]Collins e Wallbanks nel 1992 hanno proposto di rinominare la specie Lactobacillus minutus, Lactobacillus Rimaee, Streptococcus parvulus e Atopobium Rimae. L'Atopobium parvulum e Atopobium minutum sono stati isolati nell'uomo nelle tasche gengivali e in varie infezioni umane (ad esempio, in odontoiatria o in ascessi pelvici o ferite addominali), Ma il significato clinico delle specie di Atopobium spp non è stato chiaramente definito fino ad oggi. Ciò potrebbe essere dovuto al fatto che questi batteri non sono ancora inclusi nei sistemi di indagine batterica disponibili in commercio e, pertanto, sono suscettibili di essere erroneamente identificati come Lactobacillus o Streptococco specie in base alle caratteristiche morfologiche delle loro colonie.
L'Atopobium vaginae è del genere Atopobium la specie più studiata isolata per la prima volta nel 1999, un aspetto rilevante di questo batterio e che esso difficilmente si rileva in materiale vaginale di donne sane per vaginosi batterica, mentre è presente nel 50% o più nelle secrezioni vaginali di donne con vaginosi batterica [29].
Inoltre, il batterio presenta una costante resistenza batterica all'antibiotico metronidazolo che è l'antibiotico più usato in caso di vaginosi batterica.
Nel 2003 l'Atopobium vaginae per la prima volta è stato messo in relazione con un caso patologico: un ascesso tubovarico seguito ad un prelievo di oocita per via trans-transvaginale [30].
Nel lavoro di Burton [4] del 2004 l'A. vaginae è stato isolato in donne in post menopausa, in assenza di alcuna sintomatologia, nel 44% dei prelievi vaginali effettuati.
L'Atopobium vaginae sembra essere un normale saprofita della flora batterica della vagina sana (presumibilmente con una carica batterica bassa) ma può diventare predominante per un rapido accrescimento quando si verificano le condizioni per una diminuzione della normale flora lattobacillare; ed è rilevante la compresenza di questo batterio con il più noto Gardnerella vaginalis in corso di vaginosi batterica sintomatica [3].
La presenza dell'Atopobium nelle feci umane è variabile; i vari ceppi noti della specie incrementano nel lattante quando questi sono alimentati con il latte artificiale. Inoltre, con l'età incrementano anche nelle nell'adulto [31]. Questo indica che il canale rettale è una causa importante di possibile infezione/contaminazione della vagina della donna. Specie se si sottopone a pratiche sessuali estreme o ad una cattiva igiene dei genitali esterni.
Interessante il fatto che l'aumento della quota di vegetali assunti con la normale dieta è in grado di modificare la composizione delle microflora intestinale con un aumento anche degli Atopobium spp [32] Provando che questo batterio è un possibile inquinate della vagina; la sua variabilità nella composizione della flora fecale, comporta una notevole variabilità tra donna e donna.
La presenza di un biofilm sulle pareti della vagina dove sono presenti dia la G. vaginalis e che l'A. vaginae può spiegare la difficoltà ad eradicare i due batteri spesso causa di ricorrenti infezioni vaginali [33]
Un interessante studio del 2006 esamina la flora vaginale di donne che non hanno avuto rapporti sessuali con penetrazione (vergini), rilevando una maggiore presenza di Gardenerella vaginalis rispetto l'Atopobium vagniae in queste donne, fermo restando che la maggior presenza veniva rilevato in donne che pur vergini avevano avuto rapporti sessuali orali e con le mani. Ciò mostra che la contaminazione vaginale è maggiore per la G.vaginalis; provando comunque che la contaminazione con questi 2 germi può avvenire indipendentemente dalla rapporto sessuale completo [34].
Il dato è confermato anche da Ferris 2004 che sostiene come l'A. vaginae sia raro nella donna senza vaginosi batterica [35].
Le specie di Atopobium sfruttano prevalentemente substrati proteici piuttosto che zuccherini, questo può spiegare perché sono facilmente rintracciati gli A. vaginae nella vagina della donna in postmenopausa, essendo questa, per la carena ormonale, povera in glicogeno; oppure nel cavo orale [36][37]. Infatti le donne in menopausa sottoposte a terapia ormonale sostitutiva HRT, presentano una maggiore componente lattobacillare nella vagina con un minoro rischio di vaginosi [38].
Formazione di biofilm
[modifica | modifica wikitesto]La presenza di un biofilm sulle pareti della vagina dove sono presenti dia la G. vaginalis e che l'A. vaginae può spiegare la difficoltà ad eradicare i due batteri spesso causa di ricorrenti infezioni vaginali [33].
Uno studio mostra come il biofilm batterico sia causa di un aumento delle infezioni vulvovaginali da impianto di IUD conseguenti alla formazione di un biofilm sulla superficie dello stesso[39].
Sensibilità agli antibiotici
[modifica | modifica wikitesto]L'Atopobium vaginae, è un batterio difficile da isolare in coltura, e come detto si mostra assolutamente resistente al metronidazolo (vedi bibl. indicata). Questo insieme al fatto che il batterio crea un biofilm, nel quale Gardnerella vaginalis e Atopobium vaginae sono associati, complicando la risposta alla terapia antibiotica [40][41][42].
Clindamicina
[modifica | modifica wikitesto]Un dato pubblicato [43] indica che a resistenza agli antibiotici che agiscono bloccando la sintesi proteica, è un fenomeno in crescita; infatti, il principale meccanismo di resistenza comporta un'alterazione del sito di legame dell'antibiotico mediante una metilazione ribosomale. La capacità dei batteri di metilare il recettore ribosomale è codificata dal gene erm (erythromycin methylase); questo dato spiega perché vi è un'alta probabilità di creare ceppi resistenti alla clindamicina dopo 70-90 giorni dal trattamento. La clindamicina come è noto agisce con questi meccanismi; inoltre, la clindamicina agisce anche sulla flora saprofita di tipo lattobacillare, aumentando quindi il rischio di dismicrobismo locale per la capacità eradicare anche i lactobacilli produttori di perossido d'idrogeno, ritenuto un importante fattore di difesa della normale flora vaginale [43] [44].
Metronidazolo
[modifica | modifica wikitesto]Il fallimento del trattamento con la comune terapia antibiotica a base di metronidazolo [45] [46] nelle pazienti con vaginosi batterica recidivante o persistente può essere ricondotto a diversi meccanismi:
- la concentrazione dei batteri non eradicati va incontro ad un rebound dopo la fine del trattamento antibiotico;
- i batteri vengono eradicati dalla vagina, ma reintrodotti o da reservoir endogeni o dal partner sessuale;
- i batteri sono naturalmente resistenti al trattamento con metronidazolo o clindamicina [45][47][48].
Nifuratel
[modifica | modifica wikitesto]Il Nifuratel mostra una buona attività contro l'Atopobium vaginae, infatti, non sembra presentare fenomeni di resistenza. [49]
Studi sui farmaci della classe dei nitrofurani cui appartiene il nifuratel, mostrano la capacità da parte di questi di inibire lo sviluppo di biofilm in ceppi batterici che sono causa di infezioni urinarie [50][51][52].
Aspetti immunologici
[modifica | modifica wikitesto]L'Atopobium vaginae stimola la risposta immune da parte delle cellule epiteliali della vagina, infatti si ritrova un aumento della produzione di citochine locali (IL-6, IL-8) e difensine (beta-defensin 4) cosa che può contribuire alla patogenesi della vaginosi batterica e delle sue manifestazioni cliniche [53].
Aspetti ormonali
[modifica | modifica wikitesto]Il lavoro recente di Srinivasan et al. del 2010, mette in relazione i cambiamenti della flora batterica della vagina femminile con i cambiamenti ormonali nel corso del ciclo. In particolare l'A. vaginae si sviluppa in modo importante durante il periodo mestruale insieme ad altri patogeni. Nello studio si osserva come occorrano più cicli di terapia antibiotica con metronidazolo per ottenere una eradicazione delle specie ritenute patogene per la vaginosi batterica [54].
Complicanze cliniche
[modifica | modifica wikitesto]Le infezioni vaginali e cervicali da A. vaginae tendono a risalire localmente causando la malattia infiammatoria pelvica PID che può manifestarsi come salpingite, peritonite pelvica e ascessi tubo ovarici [30].
In donne con PROM rottura precoce delle membrane e vaginosi batterica l'A. vaginae è stato ritrovato nel liquido amniotico mostrando una possibile contaminazione di tipo ascendente. La ricerca con la polymerase chain reaction (PCR) ha permesso di isolare diverse entità batteriche e tra queste l'Atopobium vaginae che è anche causa di aumento nel neonato di: distress respiratorio, enterocoliti necrotizzanti e basso peso alla nascita. Nello stesso studio si rileva una maggiore presenza di Candida spp come causa di PROM in donne che hanno usato la spirale intrauterina[55].
L'associazione con il parto pretermine e l'infezione da A. vaginae è ampiamente documentata [56][55][57].
L'atopobium vaginae è causa di endometriti e/o ascessi tubo ovarici [58][59].
Terapia
[modifica | modifica wikitesto]L'Atopobium vaginae è:
- sensibile
- clindamicina ° °° [66]
- nifuratel °°[67] Suscetibility Atopobium vaginae to nifuratel. Abstract presentato all'EADV Spring, a cura di Mailland F, Togni G, Battini V, M Caserini. Bucharest, 23-26, April 2009. [3]
- rifampicina °[66]
- azitromicina °[66]
- penicillina °[66]
- ampicillina °[66]
- ciprofloxacina °[66]
Legenda: °: sistemico, °°: topico
Note
[modifica | modifica wikitesto]- ^ (EN) Atopobium, in Bacterio.net. URL consultato il 4 giugno 2014.
- ^ a b c Rodriguez Jovita M, Collins MD, Sjödén B, Falsen E. Characterization of a novel Atopobium isolate from the human vagina: description of Atopobium vaginae sp. nov. Int J Syst Bacteriol. 1999 Oct;49 Pt 4:1573-6. PubMed PMID 10555338.
- ^ a b Verhelst R, Verstraelen H, Claeys G, Verschraegen G, Delanghe J, Van Simaey L, De Ganck C, Temmerman M, Vaneechoutte M. Cloning of 16S rRNA genes amplified from normal and disturbed vaginal microflora suggests a strong association between Atopobium vaginae, Gardnerella vaginalis and bacterial vaginosis. BMC Microbiol. 2004 Apr 21;4:16. PMID 15102329
- ^ a b Burton JP, Devillard E, Cadieux PA, Hammond JA, Reid G. Detection of Atopobium vaginae in postmenopausal women by cultivation-independent methods warrants further investigation. J Clin Microbiol 2004; 42: 1829-1831.PMID 15071062
- ^ Burton JP, Chilcott CN, Al-Qumber M, Brooks HJ, Wilson D, Tagg JR, Devenish C. A preliminary survey of Atopobium vaginae in women attending the Dunedin gynaecology out-patients clinic: is the contribution of the hard-to-culture microbiota overlooked in gynaecological disorders? Aust N Z J Obstet Gynaecol. 2005 Oct;45(5):450-2. PMID 16171487.
- ^ M. J. Ferris, et al., Use of Species-Directed 16S rRNA Gene PCR Primers for Detection of Atopobium vaginae in Patients with Bacterial Vaginosis. JOURNAL OF CLINICAL MICROBIOLOGY, Dec. 2004, p. 5892–5894 Vol. 42, No. 12 PMID
- ^ Collins & Wallbanks, 1993
- ^ (Bailey & Love, 1986)
- ^ Kageyama A, Benno Y, Nakase T. Phylogenic and phenotypic evidence for the transfer of Eubacterium fossor to the genus Atopobium as Atopobium fossor comb. nov. Microbiol Immunol. 1999;43(5):389-95. PubMed PMID 10449244.
- ^ (Hauduroy et al., 1937)
- ^ Altonsy MO, Andrews SC, Tuohy KM. Differential induction of apoptosis in human colonic carcinoma cells (Caco-2) by Atopobium, and commensal, probiotic and enteropathogenic bacteria: mediation by the mitochondrial pathway. Int J Food Microbiol. 2010 Feb 28;137(2-3):190-203. Epub 2009 Dec 5. PubMed PMID 20036023.
- ^ Lau SK, McNabb A, Woo GK, Hoang L, Fung AM, Chung LM, Woo PC, Yuen KY.Catabacter hongkongensis gen. nov., sp. nov., isolated from blood cultures of patients from Hong Kong and Canada. J Clin Microbiol. 2007 Feb;45(2):395-401.Epub 2006 Nov 22. PubMed PMID 17122022;
- ^ Eschenlauer SC, McKain N, Walker ND, McEwan NR, Newbold CJ, Wallace RJ.Ammonia production by ruminal microorganisms and enumeration, isolation, and characterization of bacteria capable of growth on peptides and amino acids from the sheep rumen. Appl Environ Microbiol. 2002 Oct;68(10):4925-31. PubMed PMID 12324340;
- ^ Jousimies-Somer H. Recently described clinically important anaerobic bacteria: taxonomic aspects and update. Clin Infect Dis. 1997 Sep;25 Suppl 2:S78-87. Review. PubMed PMID 9310640.
- ^ (Weinberg et al., 1937) Collins & Wallbanks, 1993
- ^ Riggio MP, Lennon A, Rolph HJ, Hodge PJ, Donaldson A, Maxwell AJ, Bagg J. Molecular identification of bacteria on the tongue dorsum of subjects with and without halitosis. Oral Dis. 2008 Apr;14(3):251-8. PubMed PMID 18336372.
- ^ Kumar PS, Griffen AL, Barton JA, Paster BJ, Moeschberger ML, Leys EJ. New bacterial species associated with chronic periodontitis. J Dent Res. 2003 May;82(5):338-44. PubMed PMID 12709498.
- ^ Kazor CE, Mitchell PM, Lee AM, Stokes LN, Loesche WJ, Dewhirst FE, Paster BJ. Diversity of bacterial populations on the tongue dorsa of patients with halitosis and healthy patients. J Clin Microbiol. 2003 Feb;41(2):558-63. PubMed PMID 12574246.
- ^ Downes J, Munson MA, Spratt DA, Kononen E, Tarkka E, Jousimies-Somer H, Wade WG. Characterisation of Eubacterium-like strains isolated from oral infections. J Med Microbiol. 2001 Nov;50(11):947-51. PubMed PMID 11699590.
- ^ (Olsen et al., 1991) Collins & Wallbanks, 1993
- ^ Chung HY, Sung H, Lee MY, Yoon NS, Lee SG, Suh DJ, Kim MN. [A case of bacteremia by Atopobium rimae in a patient with liver cirrhosis]. Korean J Lab Med. 2007 Oct;27(5):351-4. Korean. PubMed PMID 18094600.
- ^ Rodriguez Jovita et al., 1999
- ^ a b Collins, M. D. 81 Wallbanks, S. (1992). Comparative sequence analysis of the 16s rRNA genes of Lactobacillus minutus, Lactobacillus rimae and Streptococcus parvulus: proposal for the creation of a new genus Atopobium. FEMS Microbiol Lett 95, 235-240. PMID
- ^ Stackebrandt, E. & Ludwig, W. (1994). The importance of using outgroup reference organisms in phylogenetic studies: the Atopobium case. Syst Appl Microbioll7, 3943. PMID
- ^ Mar Rodriguez Jovita, Matthew D. Collins, Berit Sjoden and Enevold FaIsen. Characterization of a novel Atopobium isolate from the human vagina: description of Atopobium vaginae sp. nov. International Journal of Systematic Bacteriology (1999), 49, 1573-1576. PMID
- ^ GenBank reference No. AF325325
- ^ Ferris MJ, Masztal A, Aldridge KE. Association of Atopobium vaginae, a recently described metronidazole resistant anaerobe, with bacterial vaginosis. BMC Infect Dis 2004; 4:5. PMID
- ^ Verhelst R, Verstraelen H, Claeys G, et al. Cloning of 16S rRNA genes amplified from normal and disturbed vaginal microflora suggests a strong association between Atopobium vaginae, Gardnerella vaginalis and bacterial vaginosis. BMC Microbiol 2004; 4:16. PMID
- ^ Ferris MJ, Un Masztal, Aldridge KE, Fortenberry JD, Fidel Jr PL, Martin DH. Association of Atopobium vaginae, a recently described metronidazole resistant anaerobe, with bacterial vaginosis. BMC Infect Dis. 13 feb. 2004; 04:05. PMID 15018635
- ^ a b c Geissdörfer W, Böhmer C, Pelz K, Schoerner C, Frobenius W, Bogdan C. Tuboovarian abscess caused by Atopobium vaginae following transvaginal oocyte recovery. J Clin Microbiol. 2003 Jun;41(6):2788-90. PMID 12791933
- ^ H. J. M. HARMSEN, et al., Development of 16S rRNA-Based Probes for the Coriobacterium Group and the Atopobium Cluster and Their Application for Enumeration of Coriobacteriaceae in Human Feces from Volunteers of Different Age Groups. APPLIED AND ENVIRONMENTAL MICROBIOLOGY, Oct. 2000, Vol. 66, No. 10 p. 4523–4527. PMID
- ^ Impact of sequentially increased fruit and vegetables intake on human gut microbiota Abstrat presentato al SGM Spring 2010 Meeting a cura di: N. A. KHALIL, et al., Edinburgh International Conference Centre 29 March–1 April 2010. Copia archiviata (PDF), su sgm.ac.uk. URL consultato il 5 maggio 2010 (archiviato dall'url originale il 6 maggio 2012)..
- ^ a b Recurrent bacterial vaginosis Abstrat presentato al SGM Spring 2010 Meeting a cura di: Phillip Hay, Edinburgh International Conference Centre 29 March–1 April 2010.
- ^ S. N. Tabrizi et al., Prevalence of Gardnerella vaginalis and Atopobium vaginae in Virginal Women. Sexually Transmitted Diseases, November 2006, Vol. 33, No. 11, p.663–665. PMID
- ^ M. J. Ferris, et al., Use of Species-Directed 16S rRNA Gene PCR Primers for Detection of Atopobium vaginae in Patients with Bacterial Vaginosis. JOURNAL OF CLINICAL MICROBIOLOGY, Dec. 2004, p. 5892–5894 Vol. 42, No. 12. PMID
- ^ Kazor, C. E., P. M. Mitchell, A. M. Lee, L. N. Stokes, W. J. Loesche, F. E.e Dewhirst, and B. J. Paster. 2003. Diversity of bacterial populations on the tongue dorsa of patients with halitosis and healthy patients. J. Clin. Microbiol. 41:558–563. PMID
- ^ Kumar, P. S., A. L. Griffen, J. A. Barton, B. J. Paster, M. L. Moeschberger, and E. J. Leys. 2003. New bacterial species associated with chronic periodontitis. J. Dent. Res. 82:338–344. PMID
- ^ Raz, R., and W. E. Stamm. 1993. A controlled trial of intravaginal estriol in postmenopausal women with recurrent urinary tract infections. N. Engl. J. Med. 329:753–756.PMID
- ^ Auler ME, Morreira D, Rodrigues FF, Abrao MS, Margarido PF, Matsumoto FE, Silva EG, Silva BC, Schneider RP, Paula CR. Biofilm formation on intrauterine devices in patients with recurrent vulvovaginal candidiasis. Med Mycol. 2009 Apr 7:1-6. [Epub ahead of print] PMID 19353374.
- ^ Fredricks DN, Fiedler TL, Marrazzo JM. Molecular identification of bacteria associated with bacterial vaginosis. N Engl J Med. 2005 Nov 3;353(18):1899-911. PMID 16267321.
- ^ Verstraelen H, Verhelst R, Claeys G, Temmerman M, Vaneechoutte M. Culture-independent analysis of vaginal microflora: the unrecognized association of Atopobium vaginae with bacterial vaginosis. Am J Obstet Gynecol. 2004 Oct;191(4):1130-2. PMID 15507931.
- ^ Swidsinski A, Mendling W, Loening-Baucke V, Swidsinski S, Dörffel Y, Scholze J, Lochs H, Verstraelen H. An adherent Gardnerella vaginalis biofilm persists on the vaginal epithelium after standard therapy with oral metronidazole. Am J Obstet Gynecol. 2008 Jan;198(1):97.e1-6. Epub 2007 Nov 19. PubMed PMID 18005928.
- ^ a b Beigi RH, Austin MN, Meyn LA et al. Antimicrobial resistance associated with the treatment of bacterial vaginosis. Am j Obstet Gynecol 2004; 191: 1124-9. PMID
- ^ Verstraelen H, Verhelst R, Claeys G et al. Culture-independent analysis of vaginal microflora: the unrecognized association of Atopobium vaginae with bacterial vaginosis. Am J Obstet Gynecol 2004; 191: 1130-………. PMID
- ^ a b Larsson PG, Forsum U. Bacterial vaginosis- a disturbed bacterial flora and treatment enigma. APMIS 2005; 113: 305-16. PMID
- ^ Fredricks DN, Fiedler TL, Thomas KK et al. Changes in vaginal bacterial concentrations with intravaginal metronidazole therapy for bacterial vaginosis as assessed by quantitative PCR. J Clin Microbiol 2009; 721-26. PMID
- ^ Beigi RH, Austin MN, Meyn LA et al. Antimicrobial resistance associated with the treatment of bacterial vaginosis. Am j Obstet Gynecol 2004; 191: 1124-9.PMID
- ^ Ferris MJ, Masztal A, Martin DH. Use of species-directed 16S rRNA gene PCR primers for detection of Atopobium vaginae in patients with bacterial vaginosis. J Clin Microbiology 2004; ………..5892-94. PMID
- ^ Suscetibility Atopobium vaginae to nifuratel. Abstract presentato all'EADV Spring, a cura di Mailland F, Togni G, Battini V, Caserini M. Bucharest, 23-26, April 2009. [1][collegamento interrotto]
- ^ Blango MG, Mulvey MA. Persistence of uropathogenic Escherichia coli in theface of multiple antibiotics. Antimicrob Agents Chemother. 2010 May;54(5):1855-63. Epub 2010 Mar 15. PMID 20231390
- ^ Stickler DJ, Morgan SD. Observations on the development of the crystalline bacterial biofilms that encrust and block Foley catheters. J Hosp Infect. 2008 Aug;69(4):350-60. Epub 2008 Jun 11. PMID 18550219.
- ^ Pettit RK, Weber CA, Kean MJ, Hoffmann H, Pettit GR, Tan R, Franks KS, Horton ML. Microplate Alamar blue assay for Staphylococcus epidermidis biofilm susceptibility testing. Antimicrob Agents Chemother. 2005 Jul;49(7):2612-7.PMID 15980327
- ^ Libby E. K..et al., Atopobium vaginae triggers an innate immune response in an in vitro model of bacterial vaginosis. Microbes and Infection Vol. 10, 4, April 2008, Pages 439-446. doi:10.1016/j.micinf.2008.01.004
- ^ Srinivasan S, Liu C, Mitchell CM, Fiedler TL, Thomas KK, et al. (2010) Temporal Variability of Human Vaginal Bacteria and Relationship with Bacterial Vaginosis. PLoS ONE 5(4): e10197. doi 10.1371/journal.pone.0010197 PMID
- ^ a b DB. DiGiulio, R. Romero; JP. Kusanovic; R. Gómez; CJ. Kim; KS. Seok; F. Gotsch; S. Mazaki-Tovi; E. Vaisbuch; K. Sanders; EM. Bik, Prevalence and diversity of microbes in the amniotic fluid, the fetal inflammatory response, and pregnancy outcome in women with preterm pre-labor rupture of membranes., in Am J Reprod Immunol, vol. 64, n. 1, Jul 2010, pp. 38-57, DOI:10.1111/j.1600-0897.2010.00830.x, PMID 20331587.
- ^ KH. Lim, H. Brooks; R. McDougal; J. Burton; C. Devenish; T. De Silva, Is there a correlation between bacterial vaginosis and preterm labour in women in the Otago region of New Zealand?, in Aust N Z J Obstet Gynaecol, vol. 50, n. 3, Jun 2010, pp. 226-9, DOI:10.1111/j.1479-828X.2010.01149.x, PMID 20618238.
- ^ JP. Menard, C. Mazouni; I. Salem-Cherif; F. Fenollar; D. Raoult; L. Boubli; M. Gamerre; F. Bretelle, High vaginal concentrations of Atopobium vaginae and Gardnerella vaginalis in women undergoing preterm labor., in Obstet Gynecol, vol. 115, n. 1, Jan 2010, pp. 134-40, DOI:10.1097/AOG.0b013e3181c391d7, PMID 20027045.
- ^ Y. Yamagishi, H. Mikamo; K. Tanaka; K. Watanabe, A case of uterine endometritis caused by Atopobium vaginae., in J Infect Chemother, Aug 2010, DOI:10.1007/s10156-010-0100-6, PMID 20706763.
- ^ CL. Haggerty, PA. Totten; M. Ferris; DH. Martin; S. Hoferka; SG. Astete; R. Ondondo; J. Norori; RB. Ness, Clinical characteristics of bacterial vaginosis among women testing positive for fastidious bacteria., in Sex Transm Infect, vol. 85, n. 4, Aug 2009, pp. 242-8, DOI:10.1136/sti.2008.032821, PMID 19004865.
- ^ Fredricks D N, Fiedler TL, Marrazzo JM. Molecular identification of bacteria associated with bacterial vaginosis. NJMed 2005; 353: 1899-911. PMID 16267321
- ^ Verhelst R, Verstraelen H, Claeys G. Cloning of 16 rRNA genes amplified from normal and disturbed vaginal microflora suggests a strong association between Atopobium vaginae, Gardnerella vaginalis and bacterial vaginosis.BMC Microbiology 2004; 4: 16. PMID 15102329
- ^ Verstraelen H, Verhelst R, Claeys G et al. Culture-independent analysis of vaginal microflora: the unrecognized association of Atopobium vaginae with bacterial vaginosis. Am J Obstet Gynecol 2004; 191: 1130-1134. PMID 15507931
- ^ Ferris MJ, Masztal A, Martin DH. Use of species-directed 16S rRNA gene PCR primers for detection of Atopobium vaginae in patients with bacterial vaginosis. J Clin Microbiology 2004;Dec;42(12):5892-4. PMID 15583334
- ^ Ferris MJ, Masztal A, Aldridge KE et al. Association of Atopobium vaginae, a recently described metronidazole resistant anaerobe, with bacterial vaginosis.BMC Infectious Dis 2004; 4: 5. PMID 15018635
- ^ De Backer E, Verhelst R, Vestraelen H et al. Antibiotic susceptibility of Atopobium vaginae. BMC Infectious Dis 2006; 6: 51. PMID 16542416
- ^ a b c d e f (EN) De Backer E, Verhelst R, Vestraelen H et al. Antibiotic susceptibility of Atopobium vaginae. BMC Infectious Dis 2006 Mar 16;6:51. PMID 16542416
- ^ (EN) Mendling W, Mailland F. Microbiological and pharmaco-toxicological profile of nifuratel and its favourable risk/benefit ratio for the treatment of vulvo-vaginal infections. A review. Arzneimittelforschung. 2002;52(1):8-13. PMID 11838277.
Bibliografia
[modifica | modifica wikitesto]Riviste
[modifica | modifica wikitesto]Affinché il lettore possa autonomamente seguire la letteratura sull'argomento, vengono riportati i link alle principali riviste specializzate:
- Annual Review of Microbiology, su arjournals.annualreviews.org. URL consultato il 4 maggio 2010 (archiviato dall'url originale il 20 gennaio 2009).
- journal home.asp Critical Reviews in Microbiology)
- International Journal of Systematic and Evolutionary Microbiology, su ijs.sgmjournals.org.
- Journal of Bacteriology, su jb.asm.org.
- journal home .asp Nature Reviews Microbiology, su nature.com.
- Microbiology Journal, su microbiology-journal.com. URL consultato il 4 maggio 2010 (archiviato dall'url originale il 25 novembre 2009).
Voci correlate
[modifica | modifica wikitesto]Collegamenti esterni
[modifica | modifica wikitesto]Testi OnLine
[modifica | modifica wikitesto]- (EN) Online lectures in microbiology University of South Carolina
- (EN) Microbiology Online, su ocean.edu. URL consultato il 4 maggio 2010 (archiviato dall'url originale il 17 aprile 2010).
- (EN) Online Microbiology textbook, su microbiologytext.com. URL consultato il 4 maggio 2010 (archiviato dall'url originale il 13 settembre 2008).
- (EN) Todar's Bacteriology textbook, su textbookofbacteriology.net.
- (EN) Online Medical Microbiology textbook, su pathmicro.med.sc.edu.
- (EN) GIDEON Informatics, Inc., su gideononline.com.
- (DE) Fondamenti di Microbiologia, su grundlagen-der-mikrobiologie.icbm.de.
Siti utili in Microbiologia
[modifica | modifica wikitesto]- (EN) Tassonomia Atopobium, su sn2000.taxonomy.nl. URL consultato il 2 maggio 2010 (archiviato dall'url originale il 29 settembre 2007).
- (EN) of Prokaryotic names with Standing in Nomenclature [collegamento interrotto], su bacterio.cict.fr.
- (EN) Institute of Microbiology of the Swiss Federal Institute of Technology, su micro.biol.ethz.ch.
- (EN) Information portal For Microbiology Students, su microbiologystudents.com. URL consultato il 4 maggio 2010 (archiviato dall'url originale l'8 settembre 2008).
- (EN) American Society for Microbiology, su asm.org.
- (EN) Society for General Microbiology, su socgenmicrobiol.org.uk. URL consultato il 25 giugno 2006 (archiviato dall'url originale il 5 agosto 2006).
- (EN) Society for Industrial Microbiology, su simhq.org. URL consultato il 4 maggio 2010 (archiviato dall'url originale il 29 maggio 2010).
- (FR) BACTERIO-WEB, su bacterioweb.univ-fcomte.fr.
- (FR) Société Française de Microbiologie, su sfm.asso.fr. URL consultato il 4 maggio 2010 (archiviato dall'url originale il 2 febbraio 2010).
- (ES) Sociedad Española de Microbiología, su semicro.es.
Siti utili in patologia
[modifica | modifica wikitesto]- (EN) CDC-Vaginosis, su cdc.gov.









