Forza di Debye
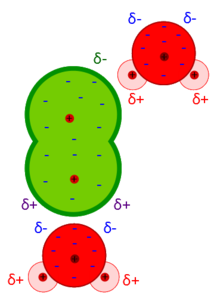
Le Forze di Debye sono forze intermolecolari risultanti dall'interazione di un dipolo permanente ed un dipolo indotto. Le forze di Debye fanno parte delle forze di van der Waals ed esprimono l'effetto d'induzione.
Dipolo indotto
[modifica | modifica wikitesto]Tutti gli atomi e molecole sono polarizzabili. Certi tipi di polarizzabilità risultano dalla deformazione della nuvola elettronica in presenza di un campo elettrico, che può essere esterno o generato da una molecola polare; il dipolo indotto viene definito come:
dove è la polarizzabilità della molecola ed è l'intensità del campo elettrico.
Interazione dipolo permanente-dipolo indotto
[modifica | modifica wikitesto]Molecola polare vs molecola apolare
[modifica | modifica wikitesto]Il potenziale d'interazione dipende dal momento dipolare della molecola polare (1).
Molecola polare vs molecola polare
[modifica | modifica wikitesto]In questo caso una molecola determina un dipolo indotto sull'altra molecola e viceversa. Il potenziale è definito come:












![{\displaystyle V=-{\frac {1}{r^{6}}}\left[{\frac {\mu _{1}^{2}\cdot \alpha _{2}}{(4\pi \cdot \varepsilon _{0}\cdot \varepsilon )^{2}}}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/34453f7ec6b0f8be76b04bbdf69e397f6c0d06cf)
![{\displaystyle V=-{\frac {1}{r^{6}}}\left[{\frac {\mu _{1}^{2}\cdot \alpha _{2}+\mu _{2}^{2}\cdot \alpha _{1}}{(4\pi \cdot \varepsilon _{0}\cdot \varepsilon )^{2}}}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c4526e1e9ebea5d44fac2540b2e1461569c9e77c)