In chimica organica, con il termine sostituzione elettrofila aromatica (abbreviato in SEA o SEAr) si indica una particolare tipologia di reazioni chimiche accomunate dall'avere identico meccanismo di reazione, nelle quali un atomo (in genere idrogeno) legato ad un anello aromatico è sostituito da un gruppo elettrofilo.
Le reazioni di sostituzione elettrofila aromatica vengono sfruttate sia in ambito industriale che in laboratorio,in quanto permettono di preparare dei composti aromatici sostituiti da un gran numero di gruppi funzionali (come ad esempio medicinali quali paracetamolo, acido acetilsalicilico, ecc.), seguendo la generica reazione:
- ArH + EX → ArE + HX
in cui Ar indica un composto aromatico ed E indica un gruppo elettrofilo.
Meccanismo generale della reazione
[modifica | modifica wikitesto]
Il primo step del meccanismo è un'addizione durante la quale il composto elettrofilo A+ reagisce con un doppietto elettronico dell'anello aromatico. Questo step necessita generalmente di un catalizzatore (in particolare un acido di Lewis) e conduce alla formazione di un carbocatione cicloesadienile conosciuto come intermedio di Wheland (o complesso σ, o ione arenio). Questo carbocatione, sebbene più sia più instabile dal composto aromatico da cui ha origine (infatti non presenta aromaticità) è relativamente stabile per la presenza di una carica sulla molecola, che è delocalizzata su molteplici atomi di carbonio (si ha quindi mesomeria).
Durante la seconda tappa, la base coniugata dell'acido di Lewis (oppure un anione presente nel mezzo della reazione, ad esempio nel caso della solfonazione) attacca l'atomo di idrogeno legato all'atomo di carbonio che aveva precedentemente subito l'addizione elettrofila. L'elettrone che era utilizzato per il legame C-H permette quindi al composto di ritrovare la sua aromaticità.
Principali sostituzioni elettrofili aromatiche
[modifica | modifica wikitesto]Esistono molte reazioni di sostituzione elettrofila aromatica utilizzate nell'industria e in laboratorio. Per ognuna di esse, il meccanismo di reazione è dato dal caso particolare del benzene. Questo meccanismo è simile per tutti gli altri tipi di composti aromatici, a condizioni di reazione (temperatura, solvente, ...) simili.
Nitrazione aromatica
[modifica | modifica wikitesto]La nitrazione aromatica è una sostituzione elettrofila aromatica particolare nella quale un atomo d'idrogeno legato ad un atomo di carbonio dell'anello aromatico è sostituito da un gruppo nitro -NO2 per formare nitrobenzene. L'elettrofilo utilizzato per la sostituzione è NO2+ (Ione nitronio), prodotto in-loco.
Nella pratica sperimentale, per effettuare la sostituzione, il benzene viene sottoposto al ( a 50 °C circa) in una miscela acido solforico e acido nitrico. La reazione è la seguente:
- (1) 2H2SO4 + HNO3 → 2HSO4- + NO2+ + H3O+
- (2) C6H6 + NO2+ → C6H5NO2 + H+
- (3) H+ + H3O+ + 2HSO4- → H3O+ + H2SO4 + HSO4-
L'acido solforico gioca in qualche modo il ruolo di catalizzatore per la formazione dello ione nitronio. La reazione è possibile anche utilizzando solamente acido nitrico, ma è molto più lenta. Tra gli altri reagenti utilizzabili per la nitrazione aromatica, da citare il tetrafluoroborato di nitronio, che è un sale di nitronio ottenuto a partire dal fluoruro di idrogeno, acido nitrico e trifluoruro di boro.


Se la reazione è catalizzata in presenza di acido solforico, la tappa cineticamente determinante è la nitrazione dell'anello benzenico per formare l'intermediario di Wheland. In presenza di solo acido nitrico, esso serve alla formazione dello ione nitronio.
Il nitrobenzene che si viene a formare durante questa reazione può anche essere usato per sintetizzare l'anilina per riduzione:
- C6H5NO2 + 3H2 → C6H5NH2
Solfonazione aromatica
[modifica | modifica wikitesto]
La sulfonazione aromatica è una sostituzione elettrofila aromatica particolare nella quale un atomo d'idrogeno legato ad un atomo di carbonio dell' anello aromatico è sostituito da un gruppo acido solfonico. Nel caso del benzene, la reazione permette di formare acido benzensolfonico. La sostituzione può essere realizzata in due modi:
- Il benzene è mantenuto a 25 °C in oleum, soluzione di SO3 in acido solforico
(H2SO4) o miscela di SO3 ed acqua (con SO3 come elemento principale. L'equazione chimica è quindi:
- C6H6 + SO3 → C6H5SO3H
- Il benzene è riscaldata in acido solforico concentrato. SO3 è allora formato "in-situ" mediante reazione diretta tra acido solforico su di lui stesso. L'equazione chimica è quindi:
- C6H6 + 2 H2SO4 → C6H5SO3H
In entrambi i casi la reazione è la seguente:

Per la solfonazione, l'eliminazione dell'atomo di idrogeno ha luogo mediante una reazione intramolecolare. Questa reazione non possiede una tappa cineticamente determinante. Si tratta di una reazione reversibile: è infatti possibile eliminare il gruppo solfonico e rigenerare il benzene riscaldando l'acido benzensolfonico in una soluzione diluita di acido solforico in acqua surriscaldata. L'equazione chimica è allora:
- C6H5SO3H + H2O(vapore) → C6H6 + HSO4- + H3O+
L'acido benzensolfonico formato durante questa reazione è un intermediario di grande rilievo nelle industrie chimiche, utilizzato infatti nella fabbricazione di coloranti e prodotti farmaceutici. Quindi è anche possibile ridurlo in presenza di soda caustica fusa per formare fenolo.
Alogenazione aromatica
[modifica | modifica wikitesto]L'alogenazione aromatica è una sostituzione elettrofila aromatica nella quale un atomo di idrogeno legato ad un atomo di carbonio dell'anello aromatico è sostituito da un alogeno seguendo questa reazione:
- C6H6 + X2 → C6H5X + HX
La reazione non è spontanea, ma necessita della presenza di un catalizzatore, precisamente un acido di Lewis, ad esempio il cloruro di alluminio. Si deve effettuare in un mezzo anidro. E' anche possibile senza catalizzatore (ma allora diventa molto lenta) nel caso dell'anello attivato, come ad esempio il fenolo. L'alogenazione aromatica permette di sostituire un atomo d'idrogeno con uno di cloro, di bromo o di iodio. Non è però possibile con il fluoro. In effetti lui è un elemento fortemente ossidante che attiva una degradazione del composto aromatico. Il meccanismo della reazione è il seguente (nell'esempio si tratta di una clorurazione):

Durante la prima tappa del meccanismo, l'acido di Lewis utilizzato come catalizzatore forma un complesso con il cloro molecolare, che rende polare il legame Cl-Cl. Di conseguenza, uno degli atomi di cloro diventa elettrofilo e può subire l'attacco nucleofilo dell'anello aromatico, conducendo così alla formazione dell'intermediario di Wheland. L'anione formato contribuisce allora nella seconda tappa all'eliminazione dell'atomo d'idrogeno e la restaurazione dell'aromaticità.
Il catalizzatore utilizzato è generalmente un composto costituito dello stesso alogeno che si sostituirà all'idrogeno. Gli acidi di Lewis maggiormente utilizzati sono ZnCl2, AlCl3 e FeCl3 nel caso della clorurazione, e FeBr3 nella bromurazione. Nel caso dello iodio, il meccanismo di reazione è leggermente differente. In effetti, lo iodio I2 è troppo poco reattivo. Deve quindi essere accompagnato da un agente ossidante (ad esempio l'acido nitrico) per formare lo ione I+, elettrofilo, che andrà a iodurare l'anello aromatico.
Gli alogeni sono degli elementi leggermente disattivanti per l'anello aromatico. Di conseguenza, se la reazione viene catalizzata e l'alogeno è presente in eccesso, potranno verificarsi delle polisostituzioni (due o più elettrofili vengono ad addizionarsi all'anello benzenico).
Reazione di Friedel-Crafts
[modifica | modifica wikitesto]Le Reazioni di Friedel-Crafts sono un particolare tipo di sostituzione elettrofila aromatica, durante la quale un composto aromatico viene alchilato (sostituzione di un atomo d'idrogeno da parte di un gruppo alchile) o acilato (sostituzione di un atomo d'idrogeno da parte di un gruppo acile).
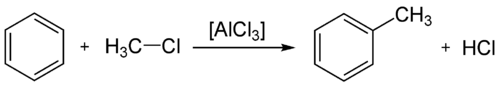
Alchilazione
[modifica | modifica wikitesto]L'alchilazione di Friedel-Crafts è la reazione di alchilazione di un composto aromatico. Questa reazione necessita di una catalisi da parte di un acido di Lewis.
Acilazione
[modifica | modifica wikitesto]L'acilazione di Friedel-Crafts è la reazione di acilazione di un composto aromatico. Come l'alchilazione, necessita di essere catalizzata da un acido di Lewis. I principali catalizzatori utilizzati sono il cloruro e il bromuro di alluminio. Generalmente non è necessario rispettare la stechiometria di reazione, poichè il catalizzatore si complessa con il prodotto, per cui necessita di un'idrolisi per distruggere il complesso ed ottenere il prodotto desiderato.

Reazione di Kolbe-Schmitt
[modifica | modifica wikitesto]La reazione di Kolbe-Schmitt (o processo di Kolbe) è una reazione di carbossilazione messa a punto A. Kolbe e R. Schmitt. Durante questa sostituzione elettrofila aromatica, del fenolato di sodio (sale del fenolo) viene riscaldato a 125 °C in presenza di anidride carbonica sotto una pressione di 100 atm, in seguito viene trattato con dell'acido solforico. L'equazione chimica è la seguente:
- C6H5OH + NaOH + H2SO4 → C6H4OHCOOH + HSO4-

Durante la prima tappa (non mostrata nello schema) il fenolo reagisce con della soda per formare il fenolato di sodio e degli ioni OH-. Il fenolato reagisce con l'anidride carbonica mediante sostituzione elettrofila aromatica, il centro elettrofilo è l'atomo di carbonio della CO2. Gli ioni OH- formati nel corso della prima fase aiutano la molecola a restaurare l'originaria aromaticità. Il composto ottenuto essendo la base coniugata dell'acido carbossilico, l'ultima fase consiste in una reazione acido-base con l'acido solforico.
Il prodotto ottenuto con questa reazione è un idrossi-acido aromatico (in questo caso l'acido salicilico, precursore dell'aspirina).
Polisostituzioni
[modifica | modifica wikitesto]Le polisostituzioni sono delle addizioni della stessa tipologia che abbiamo visto finora, ma partendo da anelli aromatici già sostituiti.
Il prodotto di una sostituzione elettrofila aromatica è esso stesso un composto aromatico: l'eliminazione di un atomo d'idrogeno permette di restaurare l'aromaticità dell'intermediario di Wheland (il carbocatione intermediario). In questo caso, il prodotto, una anello aromatico sostituito, subisce nuovamente una sostituzione elettrofila aromatica, tanto che alla fine delle polisostituzioni ne restano pochi degli idrogeni originari. In realtà, non tutti i composti aromatici potranno subire una nuova sostituzione elettrofila aromatica, e il prodotto di una seconda reazione sarà, ovviamente, dipendente dal prodotto di partenza: il gruppo funzionale presente sul composto sostituito influenza a sua volta la reattività dello stesso composto (può anche nopn subire la seconda sostituzione se la reattività è troppo bassa), così influisce anche la regioselettività della reazione (non tutti i prodotti possibili vengono formati).
Reattività delle reazioni di polisostituzione
[modifica | modifica wikitesto]Il gruppo funzionale presente sul composto sostituito influenza fortemente la sua reattività. Questi gruppi funzionali sono stati classificati in due categorie: dei gruppi attivanti e dei gruppi disattivanti. Un composto aromatico sostituito da un gruppo attivante è più reattivo rispetto al composto non sostituito. Al contrario, un composto aromatico sostituito da un gruppo disattivante è meno reattivo. Queste regole sono state enunciate dal chimico Holleman nel 1910 e sono conosciute come regole di Holleman.
Gruppi attivanti
[modifica | modifica wikitesto]Un gruppo attivante è un gruppo la cui presenza aumenta la reattività dell'anello aromatico ottenuto dalla sostituzione elettrofila aromatica rispetto all'anello in cui il gruppo è assente. La reattività dell'anello verrà aumentata se bisogna fornire meno energia per passare dal composto di partenza all'intermediario di Wheland. Questo comprenderà certamente i casi di mesomeri donatori, come ad esempio il gruppo alcoolico -OH. La figura qui sotto mostra la stabilizzazione per mesomeria del fenolo e dell'intermediario di Wheland corrispondente:
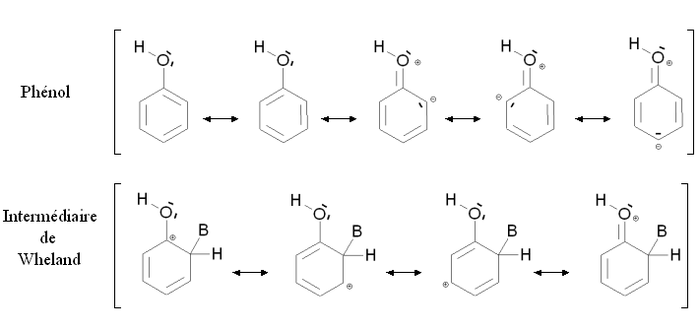
Il fenolo e l'intermediario di Wheland sono entrambi stabilizzati per mesomeria delocalizzando gli elettroni dell'anello aromatico. E' anche possibile scrivere le formule dei mesomeri mettendo in gioco un doppietto elettronico dell'ossigeno. Nel caso del fenolo, queste forme mesomeriche fanno apparire delle cariche formali sull'ossigeno ed un atomo di carbonio, non portano che ad una minima stabilizzazione. Al contrario, nel caso dell'intermediario di Wheland, non appare nessuna carica supplementare: la stabilità della molecola è molto forte. L'intermediario di Wheland è quindi più stabile del fenolo per la presenza di un gruppo alcoolico -OH.

Questa situazione è riassunta dallo schema sopra riportato, comparandolo con il benzene (composto aromatico non sostituito). Gli stati fittizi (punteggiati) corrispondono ad una situazione ove la presenza del gruppo -OH sarà neutra, cioè una situazione ove nell'intermediario non interverrà il doppietto elettronico portato dall'ossigeno. in questo caso l'energia del fenolo e dell'intermediario di Wheland sarà la stessa del benzene. I tratti interi corrispondono alla sitazione reale: l'intermediario di Wheland è più stabile ripetto al fenolo (la sua energia è minore). Di conseguenza, lo scarto energetico tra il fenolo e l'intermediario di Wheland ΔE2 è minore rispetto allo scarto nel caso del benzene ΔE1. Il fenolo è quindi più reattivo del benzene nei riguardi della sostituzione elettrofila aromatica.
In generale sono attivanti tutti quei gruppi in grado di stabilizzare la carica positiva dell'intermediario di Wheland, o per mesomeria, o per effetto induttivo, cioè i gruppi mesomero-donatori ed induttivo-donatori.
Gruppi disattivanti
[modifica | modifica wikitesto]Un gruppo disattivante è un gruppo funzionale la cui presenza diminuisce la reattività dell'anello aromatico verso la sostituzione elettrofila aromatica in rapporto all'anello in cui tale gruppo funzionale è assente. Una sostitusione di un anello aromatico, non ancora sostituito, da un gruppo disattivante condurrà molto raramente ad una polisostituzione. La reattività dell'anello aromatico verrà diminuita se occorre fornire più energia per passare dal composto di partenza all'intermediario di Wheland, cioè se lo scarto energetico tra il composto di partenza e l'intermediario di Wheland è maggiore. Questo è ovviamente il caso dei gruppi mesomero attrattori, come ad esempio il gruppo nitro -NO2. La figura qui sotto mostra la stabilizzazione per mesomeria del nitrobenzene e del corrispondente intermediario di Wheland:
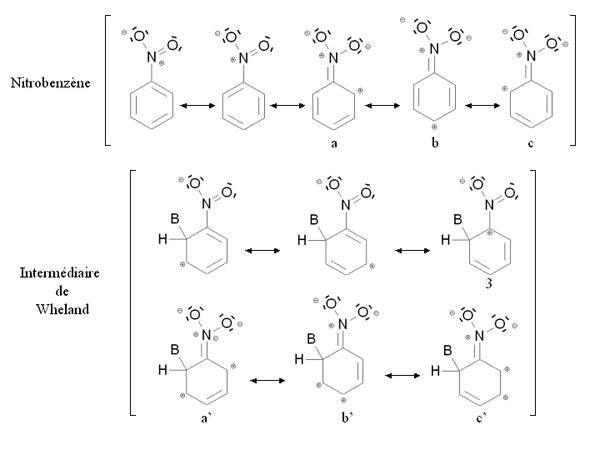
Il nitrobenzene e l'intermediario di Wheland sono entrambi stabilizzati dal fenomeno della mesomeria, cioè delocalizzando gli elettroni dell'anello su tutta la molecola. Comunque nel caso della forma mesomerica 3 dell'intermediario di Wheland, l'atomo di carbonio legato al gruppo nitro (molto elettronegativo) è caricato positivamente. Questa forma mesomerica è dunque molto poco stabilizzante: l'intermediario di Wheland è meno stabile rispetto al nitrobenzene e la presenza del gruppo nitro induce una destabilizzazione in rapporto ad una situazione in cui il gruppo funzionale, in questo caso nitro, sia assente. E' anche possibile scrivere delle formule mesomeriche mettendo in gioco un doppietto elettronico dell'atomo di azoto (a, b, c e a', b', c'). Comunque nel caso delle formule mesomeriche b' e c' dell'intermediario di Wheland, due cariche positive vengono portate da degli atomi di carbonio uniti, che corrisponde ad una configurazione elettronica molto poco stabile. Inoltre, l'intermediario di Wheland è meno stabilizzato rispetto al nitrobenzene.

Questa situazione è riassunta dalla figura qui sopra facendo il confronto con il benzene (anello aromatico non sostituito). Lo stato fittizio (punteggiato) corrisponde ad una situazione in cui il gruppo -NO2 non interverrà nell'intermediario di Wheland con i doppietti portati dall'azoto. Lo stato fittizio dell'intermediario di Wheland è meno stabile rispetto a quello del benzene (a causa della carica positiva nella formula mesomerica 3). Comunque, il nitrobenzene (con energia minore) a causa delle cariche portate dagli atomi di carbonio legati nelle formule mesomeriche b' e c'. Di conseguenza lo scarto energetico tra il nitrobenzene e l'intermediario di Wheland ΔE2 è maggiore rispetto allo scarto nel caso del benzene ΔE1. Il nitrobenzene è quindi meno reattivo rispetto al benzene verso la sostituzione elettrofila aromatica.
In generale, saranno disattivanti tutti i gruppi funzionali in grado di destabilizzare la carica positiva dell'intermediario di Wheland, o per mesomeria, o per effetto induttivo, per cui saranno disattivanti i gruppi mesomero attrattori ed induttivo attrattori.
Reattività di alcuni composti sostituiti
[modifica | modifica wikitesto]La reattività di un composto aromatico sostituito nei confronti di un'ulteriore sostituzione elettrofila aromatica dipende fortemente dalla natura del gruppo sostituente già presente. La reattività è molto più grande nel caso in cui il sostituente porte degli elettroni al sistema stabilizzando le cariche positive (effetto mesomerico-donatore ed induttivo-donatore). La tabella qui sotto ci fornisce qualche ordine di grandezza riguardo la reattività (in rapporto a quella del benzene, fissata ad 1) di qualche benzene sostituito. Il fenolo è 1000 volte più reattivo del benzene, mentre il nitrobenzene lo è 10 000 volte in meno.
| Sostituenti | -N(CH3)2 | -OH | -CH3 | -H | -Cl | -COOH | -NO2 |
| Reattività | 9000000 | 1000 | 25 | 1 | 0,3 | 4.10-3 | 1.10-4 |
Regioselettività
[modifica | modifica wikitesto]
Quando un composto aromatico sostituito subisce una seconda sostituzione elettrofila aromatica, l'attaccaggio del secondo sostituente può avvenire solo du cinque posizioni. Tra queste posizioni, due vengono chiamate orto, due sono meta ed una para (vedi figura a destra).
A prima impressione, si potrebbe pensare che il prodotto della reazione sia una miscela costituita dal 40% di isomeri orto, da 40% di isomeri meta e da 20% di isomero para, secondo una rapporto di 2:2:1. In realtà non è così, poichè la regioselettività della reazione (e quindi la natura del prodotto finale) dipende fortemente da gruppo funzionale già presente sull'anello aromatico sostituito. Conseguentemente alla natura di tale gruppo, la seconda sostituzione potrà avere luogo esclusivamente nelle posizioni meta oppure il prodotto sarà costituito da una miscela di isomeri orto e para.
Gruppi orto-para orientatori
[modifica | modifica wikitesto]Sperimentalmente, una sostituzione elettrofila aromatica che utilizza come prodotto di partenza un anello aromatico sostituito da un gruppo donatore (mesomero-donatore o induttivo-donatore) porterà ad una miscela di isomeri orto e para, con una minima quantità di isomero meta. Questo risultato può essere sipegato mediante delle considerazioni energetiche molto semplici.

Per poter passare dal composto di partenza ad un intermediario reazionale durante una reazione chimica, c'è bisogno di fornire energia per infrangere una barriera di potenziale. La velocità di reazione sarà tanto maggiore quanto più piccola sia tale barriera, e quindi quanto più stabile sarà l'intermediario reazionale. Nel caso della sostituzione elettrofila aromatica, si può considerare con una buona approssimazione che il prodotto finale formato più rapidamente sarà quello il cui intermediario di Wheland si forma più rapidamente (reazione sotto controllo cinetico), per cui il prodotto che si forma più rapidamente, e cioè in maggiori quantità, deve corrispondere all'intermediario di Wheland più stabile.








