Indice
Metamizolo
| Metamizolo | |
|---|---|
 | |
 | |
| Nome IUPAC | |
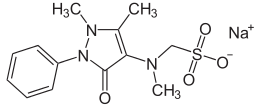
| Sodio [(2,3-diirdo-1,5-dimetil-3-osso-2-fenil-
1H-pirazol-4-il)metilamino] metanosolfonato | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C13H16N3NaO4S |
| Massa molecolare (u) | 311,358 |
| Numero CAS | |
| Numero EINECS | 200-694-7 |
| Codice ATC | N02 |
| PubChem | 80254 |
| SMILES | CC1=C(C(=O)N(N1C)C2=CC=CC=C2)N(C)CS(=O)(=O)[O-].[Na+] |
| Dati farmacocinetici | |
| Metabolismo | AM404, P Cytochrome P 450, glutatione |
| Emivita | 1 -4 ore |
| Escrezione | renale |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |

| |
| attenzione | |
| Frasi H | 361 |
| Consigli P | 281 [1] |
Il metamizolo (precisamente metamizolo sodico o dipirone monoidrato) è un farmaco analgesico non steroideo. Il più noto nome commerciale è Novalgina (prodotto da Sanofi). Viene utilizzato come antipiretico ed antidolorifico contro cefalee, febbre, dolori dentari, dolori mestruali ed altri.
Il dipirone è comunemente usato in Italia, Spagna, Giappone ed altri paesi, mentre è stato ritirato dal mercato negli USA, e nel Regno Unito non è mai stato registrato in quanto in questi paesi si è ritenuto che il profilo rischio-beneficio non ne giustificasse l'uso.
Meccanismo d'azione
[modifica | modifica wikitesto]Studi clinici hanno dimostrato che l'attività antipiretica del dipirone è nettamente superiore al paracetamolo nonché all'ibuprofene. Il farmaco riesce anche a mantenere la temperatura corporea bassa più a lungo rispetto all'ibuprofene e al paracetamolo. Sembra che il meccanismo principale non sia l'inibizione della cicloossigenasi II, ma dell'isoforma III recentemente scoperta a livello cerebrale, che medierebbe l'analgesia e la piressia di origine centrale. Tuttavia la sua assunzione comporta certi rischi; nello specifico l'assunzione di metamizolo sodico comporta un aumento del rischio di sviluppare agranulocitosi[2].
Il metamizolo può provocare anche ipotensione. Questo effetto collaterale è stato spiegato con la scoperta che questo farmaco apre i canali del potassio ATP-dipendenti, che aperti inducono il deflusso di potassio e vengono chiusi dal legame con l'ATP. Questi canali sono tipici del pancreas in cui regolano, tramite il contenuto energetico della cellula rappresentato dall'alto contenuto di glucosio e quindi dell'ATP, la depolarizzazione della membrana cellulare l'apertura dei canali del calcio con conseguente fuoriuscita di insulina immobilizzata da granuli intracellulari. Tuttavia i canali del potassio ATP-dipendenti si trovano anche a livello della muscolatura liscia dei vasi: il Metamizolo forza la loro apertura e questo genera una ripolarizzazione della cellula, quindi i canali voltaggio dipendenti del calcio (VOCC) non possono aprirsi ed il basso contenuto di calcio non riesce ad indurre una contrazione fra actina e miosina. Il risultato sarà una più pronunciata vasodilatazione con conseguente ipotensione. Con questo stesso meccanismo si spiega anche la sua capacità di rilasciare la muscolatura bronchiale.
Effetti collaterali
[modifica | modifica wikitesto]Il metamizolo ha un potenziale di tossicità correlata al sangue (discrasie ematiche), ma provoca meno tossicità renale, cardiovascolare e gastrointestinale rispetto ai farmaci antinfiammatori non steroidei (FANS).[3] Come i FANS, può scatenare broncospasmo o anafilassi, specialmente nei soggetti affetti da asma.[4]
Gravi effetti collaterali includono agranulocitosi, anemia aplastica, reazioni di ipersensibilità (come anafilassi e broncospasmo), necrolisi epidermica tossica e può provocare attacchi acuti di porfiria, in quanto chimicamente correlata ai sulfamidici.[3] Il rischio relativo di agranulocitosi sembra variare notevolmente in base al paese delle stime su detto tasso e l'opinione sul rischio è fortemente divisa.[5] La genetica può svolgere un ruolo significativo nella sensibilità al metamizolo.[6] Si suggerisce che alcune popolazioni siano più inclini a soffrire di agranulocitosi indotta dal metamizolo rispetto ad altre. Ad esempio, l'agranulocitosi correlata al metamizolo sembra essere un effetto avverso più frequente nella popolazione britannica rispetto agli spagnoli.[7]
Secondo una revisione sistematica del 2016, il metamizolo ha aumentato significativamente il rischio di sanguinamento del tratto gastrointestinale superiore di un fattore compreso tra 1,4 e 2,7 (rischio relativo)[8]
Controindicazioni
[modifica | modifica wikitesto]Ipersensibilità precedente (come agranulocitosi o anafilassi) al metamizolo o ad uno qualsiasi degli eccipienti (es. Lattosio) nella preparazione utilizzata, porfiria acuta, ematopoiesi compromessa (come dovuta al trattamento con agenti chemioterapici), terzo trimestre di gravidanza (potenziali effetti avversi nel neonato), allattamento, bambini con peso corporeo inferiore a 16 kg, storia di asma indotta da aspirina e altre reazioni di ipersensibilità agli analgesici.[9]
Overdose
[modifica | modifica wikitesto]È considerato abbastanza sicuro in caso di sovradosaggio, ma in questi casi sono generalmente consigliate misure di supporto e misure per limitare l'assorbimento (come carbone attivo) e accelerare l'escrezione (come l'emodialisi).[9]
Farmacologia
[modifica | modifica wikitesto]Il suo preciso meccanismo d'azione è sconosciuto, anche se si ritiene che potrebbe essere coinvolta la sintesi di inibizione delle prostaglandine del cervello e del midollo spinale (molecole simili a grassi che sono coinvolte nell'infiammazione, nel dolore e nella febbre).[10] Recentemente, i ricercatori hanno scoperto un altro potenziale meccanismo che prevede che il metamizolo sia un profarmaco. In questa proposta, non ancora verificata da altri ricercatori, il metamizolo stesso si scompone in altre sostanze chimiche che sono gli agenti attivi reali. Il risultato è una coppia di coniugati cannabinoidi e acido arachidonico FANS (anche se non nel rigoroso significato chimico della parola) dei prodotti di decomposizione del metamizolo.[11] Nonostante ciò, studi condotti su animali hanno scoperto che il recettore dei cannabinoidi CB1 non è coinvolto nell'analgesia indotta dal metamizolo.[12] Sebbene sembri inibire le febbri causate dalle prostaglandine, in particolare le prostaglandine E2,[13] il metamizolo sembra produrre i suoi effetti terapeutici per mezzo dei suoi metaboliti, in particolare N-metil-4-aminoantipirina (MAA) e 4-amminoantipirina (AA).
Storia
[modifica | modifica wikitesto]Ludwig Knorr era uno studente di Emil Fischer che vinse il premio Nobel per il suo lavoro su purine e zuccheri, che includeva la scoperta della fenilidrazina.[14] Nel 1880, Knorr stava cercando di ottenere derivati del chinino dalla fenilidrazina, e invece fece un derivato del pirazolo, che dopo una metilazione, trasformò in fenazone, chiamato anche antipirina, che è stato denominato la madre di tutti i moderni analgesici antipiretici.[15] Le vendite di quel farmaco esplose e nel 1890 i chimici della Teerfarbenfabrik Meister, Lucius & Co. (un precursore della Hoechst AG che ora è Sanofi), fecero un altro derivato chiamato piramidon che era tre volte più attivo dell'antipirina.
Nel 1893, un derivato dell'antipirina, l'aminopirina, fu prodotto da Friedrich Stolz a Hoechst.[15]Ancora più tardi, i chimici di Hoechst produssero un derivato, melubrina (sodio antipirina amminometansolfonato), che fu introdotto nel 1913,[16] e ancora più tardi il metamizolo è stato sintetizzato; Il metamizolo è un derivato metilico della melubrina ed è anche un profarmaco più solubile del pyramidon.[15] Il metamizolo fu commercializzato per la prima volta in Germania come "Novalgin" nel 1922.
Note
[modifica | modifica wikitesto]- ^ Sigma Aldrich; rev. del 26.09.2012
- ^ Dr Anthony Wong in WHO Pharmaceuticals Newsletter No. 1, 2002, p.15
- ^ a b (DE) J. Jage, R. Laufenberg-Feldmann e F. Heid, Medikamente zur postoperativen Schmerztherapie: Bewährtes und Neues, in Der Anaesthesist, vol. 57, n. 4, 1º aprile 2008, pp. 382–390, DOI:10.1007/s00101-008-1326-x. URL consultato il 4 giugno 2020.
- ^ (DE) A. Brack, H. L. Rittner e M. Schäfer, Nichtopioidanalgetika zur perioperativen Schmerztherapie, in Der Anaesthesist, vol. 53, n. 3, 1º marzo 2004, pp. 263–280, DOI:10.1007/s00101-003-0641-5. URL consultato il 4 giugno 2020.
- ^ (EN) Esther Pogatzki-Zahn, Chandani Chandrasena e Stephan Schug, Nonopioid analgesics for postoperative pain management, in Current Opinion in Anaesthesiology, vol. 27, n. 5, 2014-10, pp. 513–519, DOI:10.1097/ACO.0000000000000113. URL consultato il 4 giugno 2020.
- ^ (EN) Elena García-Martín, Gara Esguevillas e Natalia Blanca-López, Genetic determinants of metamizole metabolism modify the risk of developing anaphylaxis, in Pharmacogenetics and Genomics, vol. 25, n. 9, 2015-09, pp. 462–464, DOI:10.1097/FPC.0000000000000157. URL consultato il 4 giugno 2020.
- ^ (EN) Mérida Rodrigo L, Faus Felipe V, Poveda Gómez F, García Alegría J, [Agranulocytosis From Metamizole: A Potential Problem for the British Population], su Revista clinica espanola, 2009 Apr. URL consultato il 4 giugno 2020.
- ^ (EN) S. Andrade, D. B. Bartels e R. Lange, Safety of metamizole: a systematic review of the literature, in Journal of Clinical Pharmacy and Therapeutics, vol. 41, n. 5, 2016, pp. 459–477, DOI:10.1111/jcpt.12422. URL consultato il 4 giugno 2020.
- ^ a b Novaminsulfon injekt 2500 mg Lichtenstein Injektionslösung (PDF).
- ^ (EN) Brack A, Rittner Hl, Schäfer M, [Non-opioid Analgesics for Perioperative Pain Therapy. Risks and Rational Basis for Use], su Der Anaesthesist, 2004 Mar. URL consultato il 4 giugno 2020.
- ^ (EN) Jasiecka A, Maślanka T, Jaroszewski Jj, Pharmacological Characteristics of Metamizole, su Polish journal of veterinary sciences, 2014. URL consultato il 4 giugno 2020.
- ^ (EN) Pinar Elmas e Ahmet Ulugol, Involvement of cannabinoid CB1 receptors in the antinociceptive effect of dipyrone, in Journal of Neural Transmission, vol. 120, n. 11, 1º novembre 2013, pp. 1533–1538, DOI:10.1007/s00702-013-1052-7. URL consultato il 4 giugno 2020.
- ^ David do C Malvar, Fernando A Aguiar e Artur de L L Vaz, Dipyrone metabolite 4-MAA induces hypothermia and inhibits PGE2-dependent and -independent fever while 4-AA only blocks PGE2-dependent fever, in British Journal of Pharmacology, vol. 171, n. 15, 2014-8, pp. 3666–3679, DOI:10.1111/bph.12717. URL consultato il 4 giugno 2020.
- ^ (EN) The Nobel Prize in Chemistry 1902, su NobelPrize.org. URL consultato il 4 giugno 2020.
- ^ a b c Raviña Rubira, Enrique., The evolution of drug discovery : from traditional medicines to modern drugs, Wiley-VCH, 2011, ISBN 978-3-527-32669-3, OCLC 729616320. URL consultato il 4 giugno 2020.
- ^ (EN) JAMA: The Journal of the American Medical Association, American Medical Association., 1913. URL consultato il 4 giugno 2020.
Bibliografia
[modifica | modifica wikitesto]- Katzung J. Le basi moderne della farmacologia. Elsevier Press, 2002.
- Sabbaga J et al. Acute agranulocytosis after prolonged high-dose usage of intravenous dipyrone—a different mechanism of dipyrone toxicity? Ann Hematol. 1993 Mar;66(3):153-55.
- Chandrasekharan NV et al. COX-3, a cyclooxygenase-1 variant inhibited by acetaminophen and other analgesic/antipyretic drugs: cloning, structure, and expression. Proc Natl Acad Sci U S A. 2002 Oct 15;99(21):13926-31.
- Valenzuela F et al. Metamizol acts as an ATP sensitive potassium channel opener to inhibit the contracting response induced by angiotensin II but not to norepinephrine in rat thoracic aorta smooth muscle. Vascul Pharmacol. 2005 Aug; 43(2):120-7.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su metamizolo
Wikimedia Commons contiene immagini o altri file su metamizolo
Collegamenti esterni
[modifica | modifica wikitesto]- Farmacovigilanza, su farmacovigilanza.org. URL consultato il 4 settembre 2009 (archiviato dall'url originale il 30 settembre 2009).
| Controllo di autorità | GND (DE) 4840288-6 |
|---|









